Тема: Способи вираження складу розчинів
Мета:навчити студентів обчислювати концентрацію розчинів, сформувати уміння проводити перерахунок з одного способу вираження концентрації розчину в другий.
Знати: основні способи вираження складу розчинів.
Вміти: обчислювати концентрацію розчинів, робити розрахунки для приготування розчинів заданої концентрації.
Теоретичні передумови до заняття
Серед кількісних способів вираження концентрації найчастіше зустрічаються й застосовуються масова частка, молярна концентрація, молярна концентрація еквіваленту, моляльна концентрація.
Масова частка- ω(х) визначається відношенням маси розчиненої речовини х до маси всього розчину (в частках одиниці чи у відсотках).
 ,
, 
Масова часткапоказує скільки грамів речовини міститься в 100г розчину.
Масу речовини можна визначити як суму мас розчиненої речовини і розчинника:
m(розч.)=m(х)+m(розчинника)
Знаючи об'єм V і густину розчину ρ, його масу можна обчислити за формулою:
m(розч.)=Vּρ
Молярна концентрація с(х) показує, яка кількість розчиненої речовини υ(х) міститься в 1л розчину. Одиниці вимірювання моль/л.
 ;
;  , тоді
, тоді  ;
;
де η>(х) - кількість розчиненої речовини, моль;
V - об'єм розчину, л;
m(х) - маса розчиненої речовини, г;
М(х) - молярна маса розчиненої речовини, г/моль.
Молярна концентрація еквіваленту  показує число моль- еквівалентів розчиненої речовини, що міститься в 1л розчину.
показує число моль- еквівалентів розчиненої речовини, що міститься в 1л розчину.
|
|
|
Одиниці вимірювання моль/л.


 ;
;  ;
;  ;
;
де - число еквівалентів розчиненої речовини, моль;
 - молярна маса еквіваленту розчиненої речовини, г/моль;
- молярна маса еквіваленту розчиненої речовини, г/моль;
m(х) - маса розчиненої речовини, г;
V - об'єм розчину, л;
1/z - фактор еквівалентності.
Моляльна концентраціяb(х) показує, яка кількість розчиненої речовини міститься в 1кг розчинника. Одиниці вимірювання моль/кг.
 ;
;  ;
;

Згідно закону еквівалентів об'єми реагуючих розчинів обернено пропорційні їх молярним концентраціям еквівалентів:
 , де
, де
v1 і с(1/z х1) - об'єм (мл) і молярна концентрація еквіваленту розчину речовини х1;
v2 і с(1/z х2) - об'єм (мл) і молярна концентрація еквіваленту розчину речовини х2.
Розв'язання типових задач
Задача №1
Яка маса сульфатної кислоти необхідна для приготування 2л розчину з масовою часткою Н2SО4 20%? Густина розчину дорівнює 1,143 г/мл
Разе 'язання
1. Знаходимо масу розчину за формулою:
m розчину = Vּρ;
m розчину = 2000млּ1,143г/мл = 2286г
2. Визначимо масу розчиненої речовини за формулою:
 ;
;
 ;
;

Відповідь: m(H2SO4)=457,2г
Задача №2
Густина розчину сульфатної кислоти з масовою часткою 24,55% дорівнює 1,1790г/мл. Визначити молярну концентрацію і молярну концентрацію еквіваленту розчину сульфатної кислоти.
|
|
|
Розв'язання
1.Визначимо масу 1л розчину сульфатної кислоти
m (розчину) = Vּρ;
m (розчину) = 1,1790г/моль = 1179г
2.Знаходимо масу Н2SО4, що міститься в 1 л її розчину за формулою:


3. Визначимо молярну концентрацію розчину:


4.Знаходимо молярну концентрацію еквіваленту розчину Н2SО4 за формулою:
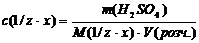

Відповідь: с(х)=2,95моль/л; с(1/zּх)=5,9моль/л.
Контрольні питання
1. При випарюванні 20г розчину одержали 4г солі. Визначити масову частку солі в розчині.
2. Яка масова частка хлориду натрію в розчині, одержаного при розчиненні 10г солі в 90г води.
3. В 2л розчину ортофосфорної кислоти міститься 19,6г Н3РО4. Визначити молярну концентрацію цього розчину.
4. Який об'єм матиме розчин купрум (II) сульфату при розчиненні у воді 1,6г CuSO4, якщо відомо, що одержаний розчин має С(СuSО4)=0,05моль/л.
5. Визначити моляльну концентрацію розчину, що містить 54г глюкози С6Н12О6 в 250г води.
6. Яка маса сульфата натрію необхідна для приготування 2л розчину молярної концентрації еквіваленту 0,4моль/л.
7. До 100мл 96% сульфатної кислоти (ρ=1,84г/моль) добавили 400мл води. Чому дорівнює масова частка одержаного розчину, якщо відома його густина (ρ =1,23г/моль).
8. 5г технічної солі NаСl розчинили у воді і одержали 200мл розчину молярної концентрації 0,2моль/л. Яка масова частка хлориду натрію в даному зразку технічної солі.
|
|
|
9. В 5л розчину молярної концентрації 6моль/л міститься 1260г речовини. Визначити молярну масу розчиненої речовини.
10.Яка маса КС1 міститься в 500мл розчину молярної концентрації 3 моль/л.
11.Чому дорівнює молярна концентрація розчину Н2SО4 з масовою часткою Н2SО4 50,5%, густина розчину дорівнює 1,40г/мл.
12.Яка маса хлориду барію необхідна для приготування 0,5л розчину молярної концентрації еквіваленту 0,5моль/л.
13.В мірній колбі місткістю 500мл приготували розчин з наважки Nа2СО3 масою 2,5г. Визначити: а) молярну концентрацію розчину; б) молярну концентрацію еквіваленту; в) титр розчину.
14.Скільки мілілітрів 96% сульфатної кислоти (ρ дорівнює 1,84г/мл) необхідно для приготування 1500мл розчину молярної концентрації еквіваленту 0,2моль/л.
15.Чому дорівнює молярна концентрація еквівалента і титр розчину NаОН, якщо на титрування 30мл розчину хлороводневої кислоти молярної концентрації еквіваленту 0,1985моль/л необхідно 16,33мл розчину NаОН. Яка маса лугу міститься в 5л такого розчину.
Тестові завдання для самоперевірки
Та контролю засвоєння знань
Дата добавления: 2018-02-28; просмотров: 1167; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
