Тема: Електролітична дисоціація
Мета:показати суть електролітичної дисоціації та роль води в цьому процесі, поглибити уявлення студентів про розчини та процес розчинення.
Знати: основні положення теорії електролітичної дисоціації і кількісні характеристики цього процесу Кдис. і α, умови протікання реакцій обміну в розчинах електролітів.
Вміти: складати рівняння реакцій йонного обміну в молекулярній та йонній формах, визначати можливість перебігу реакцій обміну між електролітами у розчині, розраховувати ступінь електролітичної дисоціації, розрізняти сильні та слабкі електроліти.
Теоретичні передумови до заняття
Електролітична дисоціація - це процес розпаду речовин на іони під впливом полярних молекул розчинника.
Речовини, що не проводять електричний струм в розчиненому або розплавленому стані, називаються неелектролітами. В молекулах неелектролітів є неполярні і мало полярні зв'язки. Це цукор, гліцерин та інші.
Речовини, розчини або розплави яких проводять електричний струм, називаються електролітами. Це сполуки з йонним і ковалентним полярним зв'язком. До них відносяться солі, кислоти, основи. Розпад електроліту на протилежно заряджені йони у водних розчинах називається електролітичною дисоціацією. Теорію електролітичної дисоціації запропонував шведський вчений Арреніус в 1887р.
В залежності від структури речовини його дисоціація відбувається по-різному. Один із можливих способів - дисоціація кристалів з йонною структурою, другий - дисоціація полярних молекул. По першому способу дисоціюють, наприклад, солі. При розчиненні їх у воді відбувається йон-дипольна взаємодія між полярними молекулами води і йонами кристалу, в результаті чого кристал руйнується.
|
|
|
По другому способу дисоціюють кислоти. Розпад їх молекул на йони - це наслідок диполь-дипольної взаємодії між полярними молекулами води і розчиненої речовини.
Не всі молекули електроліту в розчині розпадаються на йони. Відношення числа молекул, що розпалися на йони, до загального числа молекул електроліту в розчині називається ступенем дисоціації α. Вона виражається в долях одиниці або у відсотках.
Електроліти, в яких α в розчині більше 30%, називають сильними, менше 3% - слабкими. До сильних електролітів належать
майже всі солі, із найважливіших кислот і основ до них відносяться КМnO4, Н2SО4, НСlO4, НС1, НВr, НІ, КОН, NаОН, Ва(ОН)2, та інші.
До слабких електролітів відносяться більшість органічних кислот, а також Н2СО3, Н2S, НСN, НNО2, NH4ОН. До електролітів середньої сили відносяться Н3РО4, Н2SО3.
В розчинах слабких електролітів установлюється рівновага між йонами і молекулами:
|
|
|
CH3COOH  CH3COO- + H-
CH3COO- + H-
Константа рівноваги в цьому випадку називається константою дисоціації і має вигляд:
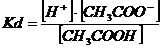
Багатоосновні кислоти і багатокислотні основи дисоціюють ступінчасто:
H3PO4  Н+ + Н2РО4- k1=7,5∙10-3
Н+ + Н2РО4- k1=7,5∙10-3
Н2РО4-  Н+ + НРО4 k2=6,3∙10-8
Н+ + НРО4 k2=6,3∙10-8
Н2РО42-  Н+ + РО43- k3=1,3∙10-12
Н+ + РО43- k3=1,3∙10-12
Ва(ОН)2  ВаОН+ + Н-
ВаОН+ + Н-
ВаОН+  Ва2+ + ОН-
Ва2+ + ОН-
Найбільшим значенням константи і ступеня дисоціації характеризується перша ступінь.
Між константою і ступенем дисоціації слабкого електроліту є взаємозв'язок: 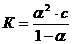
Це рівняння математичний вираз закону розбавлення Оствальда.
В розчинах електролітів реакції проходять за участю йонів. При цьому утворюються речовини з меншою розчинністю або меншим ступенем дисоціації. Реакції обміну в розчинах електролітів краще записувати у вигляді йонниих рівнянь, бо саме вони відображають суть хімічного процесу.
При складанні йонних рівнянь слід керуватися певними правилами.
Спочатку треба записати рівняння реакції у молекулярній формі та розставити коефіцієнти. Потім записати розгорнуте йоне рівняння. При цьому треба пам'ятати, що слабкі електроліти, малорозчинні (нерозчинні) речовини, гази, оксиди записують у молекулярній формі, а ступінчаста дисоціація сильних електролітів не враховується. Після скорочення однакових членів у лівій і правій частинах розгорнутого йонного рівняння записують скорочене йонне рівняння. Саме воно й відображає суть хімічного процесу в розчині. Наприклад:
|
|
|
MgCl2 + 2AgNO3 «2AgCl + Mg(NO3)2
Mg2+ + 2Cl- + 2Ag+ + 2NO3- ® 2AgCl¯ + Mg2+ + 2NO3-
Ag+ + Cl- ®AgCl¯
Умови необоротності реакцій йонного обміну:
1) якщо утворюється осад(¯)
Pb(NO3)2 + 2KI ® PbI2¯ + 2KNO3
Pb2+ + 2I- ® PbI2¯
2) якщо виділяється газ ()
Na2CO3 + H2SO4 ® Na2SO4 + H2O + CO2
CO32- + 2H+ ® H2O + CO2
3) якщо утворюється малодисаційована речовина (H2O)
Ca(OH)2 + 2HNO3 ® Ca(NO3)2 + 2H2O
H+ + OH- ®H2O
4) при утворенні комплексної сполуки
CuSO4 • 5H2O + 4NH3 ®[Cu(NH3)4]SO4 + 5H2O
Cu2+ + 4NH3 ® [Cu(NH3)4]2+
Експериментальна частина
Дата добавления: 2018-02-28; просмотров: 930; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
