Теоретичні передумови до заняття. Хімічна кінетика вивчає швидкість та механізм гомогенних та гетерогенних хімічних реакцій
Хімічна кінетика вивчає швидкість та механізм гомогенних та гетерогенних хімічних реакцій.
Швидкість хімічної реакції визначається кількістю актів перетворення за одиницю часу в одиниці об’єму (для гомогенних реакцій) або на одиниці поверхні розподілу фаз (для гетерогенних реакцій). Тому швидкість гомогенної хімічної реакції при постійному об’ємі системи вимірюється зміною концентрації реагентів за одиницю часу:

де с – концентрація будь-якого реагенту, моль/л;
t – час, с;
υ – швидкість хімічної реакції, моль/л · с.
Швидкість реакції визначається природою реагуючих речовин і залежить від умов протікання процесу (концентрації реагуючих речовин, температури, наявності каталізатору та інші).
Залежність швидкості реакції від концентрації виражається законом діючих мас: при постійній температурі швидкість хімічної реакції прямо пропорційна добутку концентрації реагуючих речовин взятих в ступенях, рівних стехіометричним показникам.
Наприклад: 2NO(г) + O2(г) = 2NO2(г)

Хімічні реакції, що проходять у гетерогенних системах, де мають місце дві і більше фаз, значно складніші. В рівнянні швидкості концентрація речовин в твердому стані формально не враховується (вона враховується константою швидкості).
Наприклад: С(к) + О2(г) = СО2(г)
υ = k[О2]
Залежність швидкості реакції від температури характеризується температурним коефіцієнтом γ , який показує у скільки разів швидкість збільшується при нагріванні на кожні 100. Згідно емпіричного правила Вант – Гоффа :при підвищенні температури на кожні 100 швидкість реакції зростає приблизно у 2-4 рази.
|
|
|
Математично це правило відображається формулою:

де γ = 2 – 4 температурний коефіцієнт реакції ;
 - значення швидкості реакції при температурі t1 і t2.
- значення швидкості реакції при температурі t1 і t2.
Одним з методів прискорення хімічних реакцій є каталіз, якій здійснюється за допомогою речовин – каталізаторів. Каталізатор бере участь у проміжній хімічній взаємодії з компонентами реакційної системи, але не входить до складу продуктів реакції.
Механізм дії каталізатора пов`язаний із зменшенням величини енергії активації, що приводить до збільшення швидкості каталітичної реакції.
Залежно від агрегатного стану каталізатора і реагуючих речовин розрізняють каталіз гомогенний (наприклад, окиснення СО у газовій фазі в присутності пару води або окиснення сульфур (IV) оксиду киснем в присутності оксиду азоту у газовій фазі) та гетерогенний, коли реагенти і каталізатор знаходяться у різних фазах (наприклад, окиснення сульфур (IV) оксиду киснем на платиновому або ванадієвому каталізаторі, синтез аміаку з водню і азоту на залізному каталізаторі).
|
|
|
Хімічна рівновага – це такий стан системи, коли швидкості прямої та зворотної реакції зрівнюються, тобто ν1=ν2. Рівновагу, яка встановилась, називають динамічною, тобто в системі продовжують перебігати і пряма, і зворотна реакції, але з однаковими швидкостями, і концентрації речовин набувають сталих значень. Такі концентрації називаються рівноважними і позначаються квадратними дужками. Стан системи після встановлення рівноваги можна передати рівнянням:
Н2 + J2 ↔ 2НJ
ν1=k1[H2]·[J2] ; ν2=k2[HJ]2
k1[H2]·[J2]=k2[HJ]2 ,
звідки 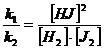
Відношення констант швидкостей k1 і k2 за сталої температури також є сталою величиною і називається константою рівноваги (К).
Тоді 
У виразі для константи хімічної рівноваги у чисельнику записують концентрації продуктів реакції, а у знаменнику – концентрації реагуючих речовин, причому беруть рівноважні концентрації. Константа рівноваги залежить не від концентрації речовин, а від природи реагуючих речовин і температури реакції.
|
|
|
Рівновага в системі встановлюється за певних умов (концентрації реагентів, температури та тиску), які називають параметрами стану системи. Проте при зміні умов рівноваги стан рівноваги порушується. Характер зміни рівноваги залежно від зовнішніх факторів можна визначити за принципом Ле-Шательє:
зміна параметрів стану урівноваженої системи призводить до збільшення швидкості тої з двох реакцій, яка протидіє даній зміні.
Експериментальна частина
Дата добавления: 2018-02-28; просмотров: 811; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
