При виконанні завдань 21-30 Ви повинні дати одну правильну відповідь у вигляді числа, знайти яке можна лише виконавши на чернетці правильно певні розрахунки
21. рН 0,01 м розчину хлоридної кислоти дорівнює:
а) 0; б) 1; в)2; г)12.
22. Концентрація гідроксид – йонів у водному розчині, що містить 0,0001 моль/л йонів гідрогену, становить:
а)10-14; б)10-10; в)10-7; г)10-14.
23. Концентрація гідроксид – йонів у водному розчині дорівнює 0,0001 моль/л. Чому дорівнює рН розчину?
а)4; б)10; в)7; г)14.
24. У розчині рН=5, тоді концентрація йонів гідрогену дорівнює:
а)10-5; б)10-9; в)10-14; г)10-10.
25. Визначте (Н+) та рН розчину хлоридної кислоти з молярною концентрацією еквіваленту 0,05 моль/л.
а)10-2 моль/л і 2; в)5 моль/л і 1,3;
б)0,05 моль/л і 1,3; г)5∙10-2 моль/л і 2.
26. Визначте (ОН-) та рН розчину NaOH з молярною концентрацією еквіваленту 0,05 моль/л.
а) 0,05 моль/л і 1,3; в) 5∙10-2 моль/л і 112,7;
б) 5∙10-2 моль/л і 11,4; г)10-2 моль/л і 12.
27. Визначте (ОН-) та рОН розчину NH4OH з молярною концентрацією еквіваленту 0,3 моль/л.
а) 2,3∙10-3 моль/і 2,64; в) 3∙10-1 моль/л і 11;
б) 3∙10-1 моль/л і 11,36; г) 5,4∙10-6 моль/л і 10,4.
28. Визначте (Н+) та рН розчину ацетатної кислоти з молярною концентрацією еквіваленту 0,2 моль/л.
а) 1,8∙10-5 моль/л і 1,88; в)1,9∙10-5 моль/л і 4,2;
б) 0,36∙10-5 моль/л і 12; г)1,9∙10-3 моль/л і 2,72.
29. Визначте концентрацію йонів гідрогену нітратної кислоти у розчині молярної концентрації 1,5∙10-3 моль/л.
|
|
|
а) 4,7∙10-2 моль/л; в) 1,5∙10-1 моль/л;
б) 7∙10-2 моль/л; г) 1,7∙10-2 моль/л.
30. Визначте концентрацію йонів гідрогену і гідроксид йонів у розчині NaOH, якщо рН=12:
а) 10-12 і 10-2; в) 10-14 і 14;
б) 12 і 2; г) 7 і 7.
Лабораторна робота № 6
Тема: Окисно-відновні реакції
Мета:закріпити теорію окисно-відновних процесів, встановити вплив середовища на характер окисно-відновного процесу.
Знати: сутність процесів окиснення-відновлення, основний принцип складання окисно-відновних реакцій методом електронного балансу
Вміти: визначати окисник і відновник в реакції, тип окисно-відновної реакції, підбирати коефіцієнти в окисно-відновних реакціях методом електронного балансу
Теоретичні передумови до заняття
Реакції, які супроводяться зміною ступенів окислення елементів, називаються окисно-відновними реакціями. Окисно-відновні процеси супроводжуються переходом валентних електронів від одних елементів до інших.
Процес віддачі електронів називається окисненням. При окисненні ступінь окиснення збільшується:
H20 - 2ē → 2H+
Коли елемент віддає електрони, він окиснюється. Такий елемент у реакціях називають відновником.
|
|
|
Процес приєднання електронів називається відновленням. При відновлені ступінь окиснення зменшується:
Mn+4 + 2ē → Mn+2
Приєднуючи електрони, елемент відновлюється й виступає в реакції окисником.
Процеси приєднання і віддавання електронів відбуваються одночасно: одні сполуки відновлюються, а інші окиснюються. Тому в окисно-відновних реакціях кількість електронів, які віддає відновник, має дорівнювати кількості електронів, які приймає окисник.
Для обчислення ступеня окиснення елемента слід враховувати наступні положення:
1. Ступінь окиснення атомів у простих речовинах дорівнює нулю ( 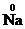 ,
,  ).
).
2. Алгебраїчна сума ступенів окиснення всіх атомів, що входять до складу молекули, завжди дорівнює нулю, а в складному йоні ця сума дорівнює заряду йона.
3. Постійний ступінь окиснення мають атоми: лужних металів (+1), лужноземельних металів (+2), Гідрогену (+1) (крім гідридів NaH, CaH2 і ін., де ступінь окиснення Гідрогену –1), Оксигену (–2) (крім F2O і пероксидів, що містять групу –O–O–, у якій ступінь окиснення Оксигену –1).
4. Для елементів позитивний ступінь окиснення не може перевищувати величину, рівну номеру групи періодичної системи.
|
|
|
Приклади:  ;
;  ;
;  ;
;  ;
;  ;
; 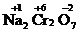 .
.
Розрізняють три основні типи окислювально - відновних реакцій:
1. Міжмолекулярні окислювально-відновні реакції.
До міжмолекулярних відносяться реакції, в яких окисник і відновник знаходяться у складі молекул або атомів різних речовин.
Наприклад: 2Са + О2 = 2СаО
2.Реакції внутрішньомолекулярного окиснення-відновлення.
В таких реакціях змінюється ступінь окиснення елементів, що входять до складу однієї речовини, тобто окисник і відновник знаходяться в одній молекулі. При цьому атом з більш високим ступенем окиснення буде окислювати атом з низьким ступенем окиснення.
Наприклад: 2КСlO3 = 3О2 + 2КСl
3.Реакції диспропорціонування.
Сюди відносяться реакції, в яких один і той же елемент є одночасно окисником і відновником.
2К2МnО4 + К2МnО4 + 2Н2О = 2КМnО4 + МnO2 + 4КОН
При складанні окисно-відновних реакцій застосовують два методи: метод електронного балансу та йонно-електронний метод.
Метод електронного балансу ґрунтується на порівнянні ступіней окиснення атомів вихідних речовин і продуктів реакції. При складанні електронного балансу слід дотримуватись такої послідовності.
1) Записують схему реакції в молекулярній формі:
KMnO4 + HCl → KCl + MnCl2 + Cl2↑+ H2O
|
|
|
2) Розставляють ступені окиснення елементів, які змінюються:
KMn+7O4 + HCl-1 → KCl + Mn+2Cl2 + Cl20↑ + H2O
3) Визначають кількість електронів, які віддає відновник, і кількість електронів, які приєднує окисник. Для цього складають рівняння, в яких кількість електронів, що приєднується або віддається, визначається як різниця між ступенями окиснення окисника і відновника до реакції і після неї:
Mn+7 + 5ē → Mn+2
2Cl-1 - 2ē→ Cl20
4) Зрівнюють число приєднаних і відданих електронів, додаткові множники і будуть коефіцієнтами для відновника та окисника.
Mn+7 + 5ē → Mn+2 2
2Cl-1 - 2ē → Cl20 5
––––––––––––––––––––––––
2Mn+7 + 10Cl-1 → 2Mn+2 + 5Cl20
5) Розставляють коефіцієнти для всіх інших речовин, що беруть участь у реакції:
2KMn+7O4 + 16HCl-1 → 2KCl + 2Mn+2Cl2 + 5Cl20 + 8H2O
Експериментальна частина
Дата добавления: 2018-02-28; просмотров: 774; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
