Энергия Гельмгольца и Гиббса
Свободная энергия Гиббса — это величина, показывающая изменение энергии в ходе химической реакции и дающая ответ на принципиальную возможность химической реакции; это термодинамический потенциал следующего вида:
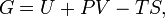
Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.)
Дифференциал энергии Гиббса для системы с постоянным числом частиц, выраженный в собственных переменных — через давление p и температуру T:

Для системы с переменным числом частиц этот дифференциал записывается так:

Здесь μ — химический потенциал, который можно определить как энергию, которую необходимо затратить, чтобы добавить в систему ещё одну частицу.
Свобо́днаяэне́ргияГельмго́льца (или просто свобо́дная эне́ргия) — термодинамический потенциал, убыль которого в квазистатическом изотермическом процессе равна работе, совершённой системой над внешними телами.
Свободная энергия Гельмгольца для системы с постоянным числом частиц определяется так:
 , где U — внутренняя энергия, T — абсолютная температура, S — энтропия.
, где U — внутренняя энергия, T — абсолютная температура, S — энтропия.
Отсюда дифференциал свободной энергии равен:

Видно, что это выражение является полным дифференциалом относительно независимых переменных T и V. Поэтому часто свободную энергию Гельмгольца для равновесного состояния выражают как функцию  .
.
Для системы с переменным числом частиц дифференциал свободной энергии Гельмгольца записывается так:
 ,
,
где μ — химический потенциал, а N — число частиц в системе. При этом свободная энергия Гельмгольца для равновесного состояния записывается как функция  .
.
14. Энергия Гельмгольца и максимальная работа. 

Энергия Гиббса и максимальная полезная работа.


Энергия Гиббса как термодинамический критерий реакционной способности химической системы.
Движущей силой химических процессов, протекающих при постоянных давлении и температуре, является изобарно-изотермический потенциал, называемый энергией Гиббсаи обозначаемый G. Изменение энергии Гиббса в химическом процессе определяется соотношением
ΔG = ΔH –TΔS, (3.16)
где ΔG – изменение энергии Гиббса химического процесса; ΔH – изменение энтальпии химического процесса; ΔS – изменение энтропии химического процесса; Т – температура, К.
Уравнение (3.16) может быть представлено в следующем виде:
ΔH = ΔG + TΔS. (3.17)
Смысл уравнения (3.17) в том, что часть теплового эффекта реакции расходуется на совершение работы (ΔG), а часть рассеивается в окружающую среду (TΔS).
Энергия Гиббса является критерием принципиальной возможности самопроизвольного протекания реакции. Если в ходе реакции энергия Гиббса уменьшается, то процесс может протекать в данных условиях самопроизвольно:
ΔG < 0. (3.18)
Процесс в данных условиях неосуществим, если
ΔG > 0. (3.19)
Выражения (3.18) и (3.19) одновременно означают, что обратная реакция не может (3.18) или может (3.19) протекать самопроизвольно.
Реакция является обратимой, т.е. может протекать и в прямом, и в обратном направлениях, если
ΔG = 0. (3.20)
Уравнение (3.20) является термодинамическим условием химического равновесия.
Соотношения (3.18) –(3.20) применимы также к фазовым равновесиям, т.е. к случаям, когда в равновесии находятся две фазы (агрегатных состояния) одного и того же вещества, например лед и жидкая вода.
Дата добавления: 2018-02-28; просмотров: 3907; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
