Теплоемкость истинная, средняя, изохорная и изобарная
Теплоемкостью называется отношение количества сообщенного системе тепла к наблюдаемому при этом повышению температуры ( при отсутствии химической реакции, перехода вещества из одного агрегатного состояния в другое и при А" = 0.)
Теплоемкость обычно рассчитывают на 1 г массы, тогда ее называют удельной (Дж/г*К), или на 1 моль (Дж/моль*К), тогда ее называют молярной.
Различают среднюю и истинную теплоемкости.
Среднейтеплоемкостью называют теплоемкость в интервале температур, т. е. отношение тепла, сообщенного телу к приращению его температуры на величину ΔТ

Истиннойтеплоемкостью тела называют отношение бесконечно малого количества теплоты, полученного телом, к соответствующему приращению его температуры.

Между средней и истинной теплоемкостью легко установить связь:
 и
и 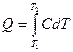
подставив значения Q в выражение для средней теплоемкости, имеем:

Истинная теплоемкость зависит от природы вещества, температуры и условий, при которых происходит переход тепла к системе.
Так, если система заключена в постоянный объем, т. е. для изохорного процесса имеем: 
Если же система расширяется или сжимается, а давление остается постоянным, т.е. для изобарного процесса имеем: 
Но ΔQV = dU, а ΔQP = dH поэтому
CV = (∂U/∂T)v , а СP = (∂H/∂T)p
(если одна или несколько переменных поддерживаются постоянными, в то время как другие изменяются, то производные называются частными по отношению к изменяющейся переменной).
Оба соотношения справедливы для любых веществ и любых агрегатных состояний. Чтобы показать связь между СV и СP , надо продифференцировать по температуре выражение для энтальпии Н=U+pV /
Для идеального газа рV=nRT

для одного моля 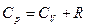 или
или 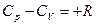
Разность R представляет собой работу изобарного расширения 1 моля идеального газа при повышении температуры на единицу.
У жидкостей и твердых тел вследствие малого изменения объема при нагревании СP = СV
Зависимость теплового эффекта химической реакции от температуры, уравнения Кирхгофа.
Используя закон Гесса, можно вычислить тепловой эффект реакции при той температуре (обычно это 298К), при которой измерены стандартные теплоты образования или сгорания всех участников реакции.
Но чаще бывает необходимо знать тепловой эффект реакции при различных температурах.
Рассмотрим реакцию:
ν AА+ν BВ= ν CС+ν DD
Обозначим через Н энтальпию участника реакции, отнесенную к 1 молю. Общее изменение энтальпии ΔΗ(Т) реакции выразится равнением:
ΔΗ = (ν C Н С +ν D НD) - (ν A Н А+ν B НВ); va, vb, vc, vd - стехиометрические коэф. х.р.
Если реакция протекает при постоянном давлении, то изменение энтальпии будет равно тепловому эффекту реакции. И если мы продифференцируем это уравнение по температуре, то получим:
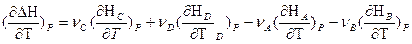
Так как 
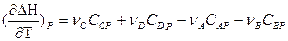
или 
Уравнения для изобарного и изохорного процесса
 и
и 
называют уравнениями Кирхгофа ( в дифференциальной форме). Они позволяют качественнооценить зависимость теплового эффекта от температуры.
Влияние температуры на тепловой эффект обусловливается знаком величины ΔСp (или ΔСV )
При ΔСp> 0 величина  , то есть с увеличением температуры тепловой эффект возрастает,
, то есть с увеличением температуры тепловой эффект возрастает,
при ΔСp< 0  то есть с увеличением температуры тепловой эффект уменьшается.
то есть с увеличением температуры тепловой эффект уменьшается.
при ΔСp = 0 - тепловой эффект реакции не зависит от температуры
То есть, как из этого следует, ΔСp определяет знак перед ΔН.
Для получения расчетной формулы уравнения Кирхгофа интегрируют в пределах интервала температур 298-Т:


Уравнения эти называются уравнениями Кирхгофа в интегральной форме. По этому уравнению можно рассчитать тепловой эффект только для узкого интервала температур.
При расчете теплового эффекта в большем интервале температур уравнение Кирхгофа интегрируют в пределах 0 –Т К и при этом учитывается зависимость теплоемкости от температуры в виде степенного ряда:

где 




Коэффициенты a,b.c находят экспериментально спектроскопическими или калориметрическими методами. Для многих веществ они приведены в справочных таблицах, ΔН0 -постоянная интегрирования.
Дата добавления: 2018-02-28; просмотров: 7108; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
