Уравнение изобары и изохоры химической реакции. Правило Ле-Шателье
Уравнение изобары:
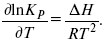
Уравнение изохоры:

По ним судят о направлении протекания реакции:

1) реакция экзотермическая. С увеличением температуры константа скорости уменьшается, равновесие смещается в сторону образовании исходных веществ.
Реакция эндотермическая. С увеличением температуры константа скорости тоже увеличивается, равновесие сдвигается в сторону образования продуктов реакции
3)∆Н=0, дробь =0
Современная формулировка принципа Ле-Шателье такова:
Если на систему,находящуюся в состоянии равновесия, оказать внешнее воздействие, то система перейдет в другое состояние так, чтобы уменьшить эффект внешнего воздействия.
1. Влияние температуры. В каждой обратимой реакции одно из направлений отвечает экзотермическому процессу, а другое - эндотермическому.
N2 + 3H2  2NH3 + Q 2NH3 + Q
|
Прямая реакция - экзотермическая, а обратная реакция - эндотермическая.
При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры - в направлении экзотермической реакции.
2. Влияние давления
При повышении давления равновесие сдвигается в направлении образования веществ (исходных или продуктов) с меньшим объемом; при понижении давления равновесие сдвигается в направлении образования веществ с большим объемом
3. Влияние концентрации. Влияние концентрации на состояние равновесия подчиняется следующим правилам:
|
|
|
При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции; при повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
Расчет константы равновесия и состава равновесной смеси с использованием термодинамических функций.
Расчёт состоит из следующих этапов:
1) расчёт константы равновесия в стандартных условиях;
2) пересчёт значений константы равновесия к заданным условиям;
3) определение равновесных концентраций веществ.
1. На первом этапе в методе расчёта, основанном на использовании стандартных термодинамических величин, применяют два исходных уравнения:

и  .
.
Расчёт  и
и  проводят по известным соотношениям следствий из закона Гесса:
проводят по известным соотношениям следствий из закона Гесса:
 .
.
Аналогично рассчитываем  .
.
По величине и знаку  судят о возможности полученных продуктов реакции из исходных веществ в стандартных условиях.
судят о возможности полученных продуктов реакции из исходных веществ в стандартных условиях.
2. На втором этапе переходит от значения  к
к  , используя уравнение Кирхгофа:
, используя уравнение Кирхгофа:

 .
.
После подстановки степенного ряда зависимости  = f(T), интегрирования и преобразований, получаем уравнение вида:
= f(T), интегрирования и преобразований, получаем уравнение вида:
 ,
,
где М0, М1, М2 – функции Темкина-Шварцмана, приведённые в соответствующих таблицах справочника физико-химических величин.
|
|
|
Константу равновесия можно рассчитать для стандартных условий, используя уравнение

и пересчитать для температуры, используя уравнение изобары или изохоры химических реакций.
Определение константы равновесия с помощью температурных функций Тёмкина-Шварцмана называется методом Тёмкина-Шварцмана по имени составителей таблиц. В результате второй стадии рассчитано  , известно общее давление.
, известно общее давление.
3. На третьей стадии определяем состав равновесной смеси в моль или молярных долях.
Пример: Определить состав равновесной смеси при взаимодействии этилена и хлорводорода.
Дата добавления: 2018-02-28; просмотров: 1906; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
