Химический потенциал и химическое равновесие
Химическое равновесие – такое состояние системы, что при некоторой температуре энтальпийный и энтропийный факторы совпадают, т.е ΔH=TΔS=0. В этом случае Δ G=0 – условие термодинамического равновесия. При термодинамическом равновесии скорость в прямом направлении равна скорости в обратном.
Химический потенциал ”μ”.Значение химического потенциала нельзя измерить, но можно рассчитать исходя из уравнения связывающего химический потенциал с составом: μi=μio+RTlnK, где K={Pi-парциальное давление, Ci-концентрация, Cmi-массовая доля, Xi-мольная доля} – константа. Для реальных растворов μi=μio+RTlnAi
Хими́ческийпотенциа́л μ — один из термодинамических параметров системы, а именно энергия добавления одной частицы в систему без совершения работы. Определение химического потенциала можно записать в виде:
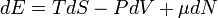
где Е — энергия системы, S — её энтропия, N — количество частиц в системе.
Эта формула определяет, кроме химического потенциала μ, также давление P и температуру T.
 ,
,
где G — потенциал Гиббса.
Если энергия системы зависит не от объёма, а от других термодинамических параметров A1,A2..., исходная формула принимает вид

Если в системе имеется несколько разных типов частиц, есть столько же разных химических потенциалов.
Парциальные и интегральные мольные величины и методы их определения.
Рассмотрим, какие еще термодинамические переменные и функции (кроме концентраций) необходимы для описания свойств растворов. Прежде всего к раствору как целому применимо понятие молярных термодинамических функций – внутренней энергии, энтальпии, энтропии, свободной энергии, относящихся к одному молю раствора. Под молем раствора подразумевают массовое количество М раствора, содержащее NA (число Авогадро) молекул, в которых представлены все компоненты раствора пропорционально их мольным долям: М = Sxi·Mi.
Молярные величины для всего раствора обозначаются заглавной буквой с нижним индексом “m”, например DHm,Sm.
Отметим, что, поскольку компоненты раствора из-за взаимного влияния есть вещества с новыми термодинамическими свойствами, термодинамические функции раствора в общем случае не есть алгебраические суммы соответствующих функций для чистых компонентов. Поэтому для описания компонентов растворов как веществ в новом состоянии используют парциальные молярные величины – внутреннюю энергию, энтальпию, энтропию, свободную энергию и т.п., относящиеся к одному молю индивидуального вещества в растворе. Парциальные молярные величины для компонентов растворов обозначаются соответствующей заглавной буквой с чертой над ней, например  .
.
Парциальные величины – аналог молярных величин для чистых веществ, но характеризующие данное вещество в конкретном растворе с конкретнойконцентрацией. Т.е., они являются функциями не только пары простых термодинамических переменных, но и всех концентраций:

Исходя из физического смысла парциальных молярных величин (характеристик компонентов раствора) и молярных величин (характеристик всего раствора), легко увидеть линейную связь между ними:
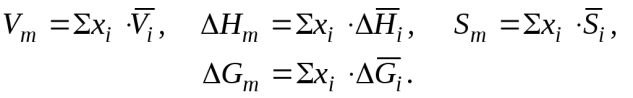 (6.1)
(6.1)
Продифференцировав (6.1) по концентрациям, получаем следующие соотношения:
 (6.2)
(6.2)
которые во многих работах используют в качестве первичных определений парциальных молярных величин. В силу существования соотношений (6.2), часто термодинамические величины, относящиеся к раствору, называют интегральными.
Парциальные величины (энтальпия, энтропия, свободная энергия и т.п.) зависят от набора и концентраций индивидуальных веществ, образующих раствор. Т.е. парциальные молярные величины должны являться функциями не только температуры и давления (как для чистых веществ), но и качественного и количественного состава раствора. Важно отметить, что для расчетов равновесий в системах, содержащих растворы, следует пользоваться условием равенства именно парциальных молярных потенциалов Гиббса индивидуальных веществво всех К фазах системы:

Здесь римские цифры означают номер фазы (раствора).
Например, давление насыщенного пара i-го компонента раствора определяется из уравнения:
 (6.3)
(6.3)
Для характеристики энергетических изменений в процессе образования раствора используют такие понятия, как термодинамические функции смешения, относящиеся как к одному молю раствора(интегральные величины), так и к каждому компоненту в отдельности(парциальные величины).Характеристики процесса смешения обозначаются верхним индексом “М” – от английскогоMixing – смешение.
Парциальные молярные характеристики смешения в металлургии вводятся по определению какразница между значением функциидля одного моля компонента в раствореи соответствующим значениемдля чистого компонента:
 (6.4)
(6.4)
По физическому смыслу это означает, что для веществ в состоянии раствора за начало отсчета термодинамических функций приняты их значения для чистых веществ:
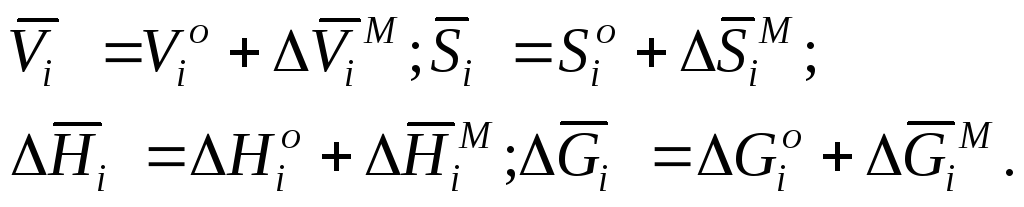 (6.5)
(6.5)
Или, по-другому, для веществ в растворах в качестве стандартного состояния выбрано их состояние в виде чистых веществ.Данный способ определения стандартного состояния для вещества в растворе называется симметричным: все компоненты раствора равноправны. Преимуществом такого выбора стандартного состояния является физическая прозрачность его формального определения и сравнительная легкость получения стандартных величин из опыта.
Интегральные молярные характеристики процесса смешения вводятся как разница между значением функции для одного моля раствора и соответствующим значением для набора чистых компонентов, взятых в количествах, необходимых для образования раствора заданного состава:
 (6.6)
(6.6)
Иными словами, интегральная молярная термодинамическая характеристика процесса смешения есть ее изменение при образовании одного моля раствора из чистых веществ, соответственно взятых в количествахxiмолей каждого.
Особое значение имеет интегральная молярная Dэнтальпия HM, называемая такжетеплотой смешенияили теплотой образования одного грамм–моля раствора. Это – тепло, которое выделяется (или поглощается) при образовании в сумме одного моля раствора изхiмолей чистых веществ и которое экспериментально легко определяется в калориметре. Измерив теплоту смешения, легко рассчитать интегральную молярную энтропиюDSM и интегральную молярную свободную Dэнергию смешения ГиббсаGM. Последняя величина есть работа, необходимая для образования одного моля раствора изхiмолей чистых веществ (за исключением работы расширения). Если свободная энергия смешения отрицательна, то процесс образования раствора (сплава) самопроизволен; если положительна – то для получения сплава придется использовать специальные технологические приемы.
В заключение приведем сводную таблицу 6.1. соотношений между парциальными и интегральными молярными величинами (на примере энтропии).
Таблица 6.1. Основные термодинамические соотношения для растворов
| молярные величины | |
| Парциальные (для i-го компонента) | Интегральные (для раствора в целом) |
| Абсолютные | |
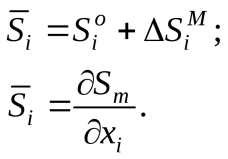
| 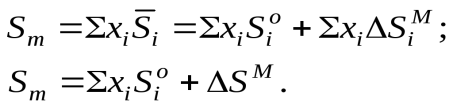
|
| Смешения | |

| 
|
Уравнение Гиббса-Дюгема.
ГИББСА-ДЮГЕМА УРАВНЕНИЕ, связывает изменения т-ры Т, давления р и хим. потенциалов  компонентов равновесных термодинамич. систем. В общем виде записывается в форме:
компонентов равновесных термодинамич. систем. В общем виде записывается в форме: 
где ni-число молей i-того компонента. Для процессов, происходящих при постоянных Т и р, Гиббса - Дюгема уравнение устанавливает связь между изменениями хим. потенциалов компонентов и Наиб. широко используется в термодинамике р-ров. Для р-ровнеэлектролитов употребительны след. формы ур-ния: 
где 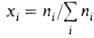 -молярная доля i-того компонента, аi-его активность, связанная с
-молярная доля i-того компонента, аi-его активность, связанная с  соотношением:
соотношением: 
 -хим. потенциал компонента в стандартном состоянии, R-газовая постоянная). Форма записи Гиббса - Дюгема уравнения для коэффициентов активности
-хим. потенциал компонента в стандартном состоянии, R-газовая постоянная). Форма записи Гиббса - Дюгема уравнения для коэффициентов активности  зависит от способа выражения концентрации (в молярных долях, молярности или моляльности). При выражении концентрации в молярных долях для р-ровнеэлектролитов
зависит от способа выражения концентрации (в молярных долях, молярности или моляльности). При выражении концентрации в молярных долях для р-ровнеэлектролитов  и Гиббса - Дюгема уравнение имеет вид: Для р-ров электролитов разработаны спец. формы
и Гиббса - Дюгема уравнение имеет вид: Для р-ров электролитов разработаны спец. формы 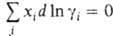 записи Гиббса - Дюгема уравнения.
записи Гиббса - Дюгема уравнения.
Гиббса - Дюгема уравнение позволяет определять зависимость от состава хим. потенциала, активности или коэф. активности одного из компонентов бинарного р-ра, если подобная зависимость известна для др. компонента (в случае многокомпонентных р-ров-для всех остальных компонентов). Гиббса - Дюгема уравнение применяют также для определения активности компонентов бинарного р-ра по данным о равновесном общем давлении пара над р-ром при данной Т.; с его помощью проверяют термодинамич. согласованность экспериментально определенных значений активности в-в.
Понятие идеального раствора.
Идеальным раствором называют раствор, для которого выполняется первый закон Рауля.
Идеальными при любых концентрациях являются растворы, компоненты которых близки по физическим и химическим свойствам (оптические изомеры, гомологи и т. п.), и образование которых не сопровождается объёмными и тепловыми эффектами. В этом случае силы межмолекулярного взаимодействия между однородными и разнородными частицами примерно одинаковы, и образование раствора обусловлено лишь энтропийным фактором.
Первый закон Рауля:
Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причём коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.

Для бинарного раствора, состоящего из компонентов А и В (компонент А считаем растворителем) удобнее использовать другую формулировку:
Относительное понижение парциального давления пара растворителя над раствором не зависит от природы растворённого вещества и равно его мольной доле в растворе.

Предельно разбавленный раствор получают путем последовательного разбавления исследуемого раствора чистым растворителем.
Дата добавления: 2018-02-28; просмотров: 3003; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
