Применение уравнение Клайперона-Клаузиуса к процессам плавления и испарения
1). Рассмотрим применение уравненияк процессам плавления. В этом случае уравнение Клапейрона–Клаузиуса обычно используют в следующей форме:
 . (17)
. (17)
ПосколькуΔHпл> 0, знак производной  зависит от знака ΔV. Для большинства веществ
зависит от знака ΔV. Для большинства веществ
 > 0
> 0 
 > 0,
> 0,
что соответствует наклону кривой  для этого фазового перехода вправо.
для этого фазового перехода вправо.
Для немногих веществ, в том числе для воды, висмута, галлия, чугуна:
 < 0
< 0 
 < 0,
< 0,
что соответствует наклону кривой  для этого фазового перехода влево.
для этого фазового перехода влево.
Итак, если при плавлении вещества его мольный объем уменьшается,то
 ,
,
т. е. при увеличении внешнего давления температура плавления вещества уменьшается.
Если плавление сопровождается увеличением мольного объема, то
 ,
,
т. е. при увеличении внешнего давления температура плавления вещества тоже увеличивается.
2). Рассмотрим применение уравнения к процессам испарения и сублимации.
Для процессов испарения или сублимации уравнение Клапейрона – Клаузиуса записывают в виде
 , (18)
, (18)
где VK — объем конденсированной фазы (жидкости VЖ или твердого тела VТВ). При температуре, гораздо ниже критической (при ТКР: VЖ = VП), можно пренебречь объёмом жидкой фазы по сравнению с объёмом того же весового количества пара. В результате уравнение (18) преобразуется в
 . (19)
. (19)
При невысоких давлениях и температурах к пару можно применить законы идеальных газов (  ) и исключить из уравнения (19) объём пара. Тогда
) и исключить из уравнения (19) объём пара. Тогда
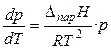 . (20)
. (20)
Окончательно для процесса испарения или сублимации получаем (дифференциальную) форму уравнения Клапейрона – Клаузиуса:
 . (21)
. (21)
Если принять ΔHпар постоянной величиной (что возможно для небольших температурных интервалов), то после интегрирования уравнения (21) получаем интегральную форму уравнения Клапейрона – Клаузиуса:
 , (22)
, (22)
или
 . (23)
. (23)
Эти уравнения устанавливает в явном виде связь теплоты парообразования вещества с зависимостью давления насыщенного пара от температуры.
Итак, для процессов парообразования  ,
,
т. е с увеличением температуры растет давление насыщенного пара вещества.
Правило фаз Гиббса
При изменении внешних параметров равновесие в системе нарушается, при этом изменяются концентрации компонентов или исчезают старые и возникают новые фазы. Изменение в системе происходит до установления нового состояния равновесия.
Этот процесс описывается основным законом состояния равновесия, который носит название правила фаз Гиббса:
В равновесной термодинамической системе, на которую оказывает влияние только давление и температура, число степеней свободы равно числу независимых компонентов минус число фаз плюс два:
С=К-Ф+2
Из этого правила следует, что при числе степеней свободы С=0 система имеет наибольшее число равновесных фаз.
Если на систему, находящуюся в равновесии, кроме давления и температуры оказывают влияние еще и другие внешние факторы, например, магнитное или гравитационное поле, электрические воздействия, то в уравнении число внешних факторов будет больше 2.
Тогда правило фаз запишется так:
С=К-Ф+n
при С=0 Ф=К+n , т.е число фаз не может быть больше, чем К+n: Ф<= К+n
Если равновесие установилось в конденсированной системе, то оно практически не смещается при небольшом изменении давления. В таком случае правило фаз Гиббса для конденсированных систем можно записать:
С=К-Ф+1
Пример. Имеем в равновесии жидкую воду, пар и лед. Рассчитаем число степеней свободы такой системы при условии влияния на систему только двух внешних параметров – давления и температуры:
С= 1-3+2= 0
Это значит, что система нонвариантна, т.е. любое изменение одного из параметров выведет систему из состояния равновесия. Значит, чтобы в системе одновременно сосуществовали все три фазы, необходимо систему держать при определенном значении давления и температуры.
Фазой называется часть системы, ограниченная физическими поверхностями раздела при переходе через которые свойства системы изменяются скачкообразно.
Числом независимых компонентов(k) называется число веществ в системе, достаточное для образования всех фаз данной системы.
Число степеней свободы (С) системы– это число независимых термодинамических параметров, которые можно произвольно менять в некоторых пределах без изменения числа и природы фаз в системе.
Дата добавления: 2018-02-28; просмотров: 3149; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
