Расчет теплового эффекта химической реакции при любой температуре по табличным термодинамическим данным. (см задачи)
Второй закон термодинамики. Математическое выражение.
В изолированных системах могут самопроизвольно протекать только процессы, идущие с увеличением энтропии (ΔS>0).
Математическое выражение второго закона термодинамики записывается:
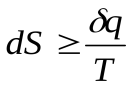
Здесь знак > относится к необратимым процессам, а знак = к обратимым. Так как энтропия является функцией состояния, ее изменение при протекании как обратимого, так и необратимого процессов одинаково. Поэтому при расчете изменения энтропии необходимо пользоваться формулами для обратимых процессов.
Энтропия обладает свойствами аддитивности, поэтому изменение энтропии в сложном процессе равно сумме изменений энтропий в отдельных его стадиях. Абсолютное значение энтропии какого-либо вещества при любой температуре можно рассчитать, если известна абсолютная энтропия при какой-то одной температуре, например, при 298К и температурные коэффициенты теплоемкости:
 ,
, 
Изменение энтропии в различных процессах вычисляют по следующим уравнениям:
При нагревании n – моль вещества от Т1 до Т2 при P = const:
 где
где 
Интегрирование дает:
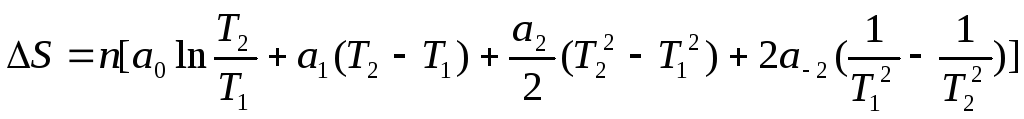

Математическое выражение для энтропии Клаузис получил из цикла Карно, на котором основана работа тепловой машины.
Рабочее тело (1 моль идеального газа ) получает от нагревателя с температурой Т1 некоторое количество теплоты Q1 и, расширяясь изотермически (кривая АВ), совершает работуА1 Далее газ расширяется адиабатно, без подвода тепла (кривая ВС) и его температура падает до Т2 . Совершаемая в этом процессе работа равна А2 .
Затем совершаются два процесса сжатия газа: изотермическое сжатие (кривая СD) при температуре Т2 в результате которого газ отдает приемнику теплоту Q2 и адиабатное сжатие (кривая ДА) с повышением температуры газа до Т1 .В процессах сжатия над газом производится работа А 3 и А 4 соответственно. Все эти процессы обратимы.
Энтропия как функция состояния и критерий направления процесса в изолированной системе.

Энтропия – критерий направления самопроизвольного процесса в изолированной системе.
В изолированных системах отсутствует подвод теплоты из внешней среды (Q = 0), поэтому, согласно II закону термодинамики (2), в изолированной системе энтропия либо остается постоянной в состоянии равновесия, либо возрастает при необратимом (самопроизвольном) течении процесса. Рост энтропии продолжается до установления равновесного состояния, при этом значение энтропии максимально Smax (рисунок- t,s-диаграмма).
Изменение энтропии однозначно определяет направление и предел самопроизвольного протекания процесса только для изолированных систем: если в результате расчета окажется, что DS> 0, процесс пойдет самопроизвольно, при DS = 0 – состояние равновесия, если DS< 0, процесс самопроизвольно протекать не будет.
Энтропия – функция состояния системы, и ее изменение не зависит от пути проведения процесса,а зависит только от конечного и начального состояния системы.
ΔS=Sкон - Sнач
Дата добавления: 2018-02-28; просмотров: 946; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
