Равновесный, обратимый и необратимый термодинамические процессы. Работа в обратимом процессе
Теплота, работа, термодинамическая система, параметры и уравнение состояния?, открытая, закрытая и изолированная системы
Теплота -это способ передачи энергии от одной части системы к другой через хаотическое движение молекул.[Дж или кДж]
Теплота связана с процессом, она зависит от пути процесса. Теплоту, полученную системой от окружающей среды, считают положительной, а теплоту, отданную системой, - отрицательной.
Конечное количество теплоты обозначают Q, а бесконечно малое количество теплоты - через dQ.
Работа - это способ передачи энергии путем упорядоченного движения большого числа частиц под действием каких-либо сил.[Дж или кДж]
Работа, как и теплота, зависит от пути процесса. Работу обозначают через W, бесконечно малую величину работы - через dW.
Системой называют отдельное тело или группу тел, фактически или мысленно отделенных от окружающей среды.Систему называют термодинамической, если между телами ее составляющими может происходить обмен теплотой, веществом, и если система полностью описывается термодинамическими параметрами (кипящий чайник).
Открытая термодинамическая система – это такая система, которая может обмениваться с окружающей средой энергией и веществом, (например, кипящий чайник).
Закрытой системой называют систему, которая не может обмениваться веществом с окружающей средой, но может обмениваться теплотой и работой. ( плотно закрытая колба с раствором, которая нагревается или охлаждается окружающей средой.)
Изолированной термодинамической системой называют систему, не имеющую обмена веществом и энергией с окружающей средой. Внутри системы может происходить передача теплоты от более нагретой части системы к более холодной, взаимное превращение энергий, выравнивание концентраций, однако внутренняя энергия системы остается постоянной. Примером такой системы является химическая реакция, идущая в термостате.
Основными параметрами состояния системы называются параметры, которые измеряются напрямую и определяются экспериментально. Это температура, давление, теплоемкость, концентрация.
Зависимость между параметрами состояния термодинамической системы выражается уравнением состояния, которое позволяет определять одни параметры состояния через другие. Если состояние системы может быть полностью описано с помощью трех параметров: давления  , объема
, объема  и температуры
и температуры  , то уравнение состояния в самом общем виде будет иметь форму
, то уравнение состояния в самом общем виде будет иметь форму
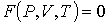
|
Обобщение многочисленных экспериментальных данных показывает, что большинство газов при комнатной температуре и давлении порядка одной атмосферы (при нормальных условиях) с достаточно высокой точностью могут быть описаны уравнением состояния, называемым уравнением Клапейрона-Менделеева:
 , ,
| (2.2) |
где: P- давление газа,V- занимаемый им объем, ν- количество молей газа,R- универсальная газовая постоянная,T- абсолютная температура.
Равновесный, обратимый и необратимый термодинамические процессы. Работа в обратимом процессе.
Процесс, который протекает бесконечно медленно и проходит через бесконечно большое число состояний равновесия, называется равновесным.
Равновесному процессу свойственна максимальная работа и двусторонность, т.е. обратимость.
Обратимым называют процесс, который может вернуться в первоначальное состояние без каких-либо энергетических изменений в окружающей среде или в самой системе под влиянием бесконечно малой силы.
Необратимым называют неравновесный процесс, который протекает в результате конечных воздействий на систему и не изменяет направления при воздействии на нее бесконечно малой силы.

Дата добавления: 2018-02-28; просмотров: 715; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
