Фишер формуласы Колли-Толленсу формуласы 7 страница
20
* 100 %
=13,75 % ;
3) w
(C H OH ) =
2,25

* 100 % =11,25 % ;
2 5 20
Жауабы: 75%, 13,75% және 11,25%
Есеп №2
Массасы 5 г сірке қышқылы мен фенол қоспасы үлгісін бейтараптандыру үшін 0,4 М NaOH ерітіндісінің 100 мл қажет болды. Қоспаның дәл осындай массасына бром суын қосқанда массасы 2,88 г тұнба түзілген. Қоспадағы сірке қышқылы мен фенолдың массалық үлестерін есептеңіз.
Шешуі:
1) есеп мазмұны бойынша қоспада төмендегі реакциялар жүреді:
CH3COOH + NaOH → CH3COONa + H2O (1) C6H5OH + NaOH → C6H5ONa + H2O (2)

 ОН ОН
ОН ОН
Вr Вr
+ 3 Вr → + 3 НВr (3)
Вr
2) 3-ші теңдеу бойынша қоспадағы фенолдың массасын анықтауға болады:
n (Br ) =
m (B r2 )

= 2,88 = 0,018 моль
|
160
1 моль С6Н5ОН ------ 3 моль Вr2
х------ 0,018 моль Вr2
x = n (C H OH ) = 0,018 = 0,006 моль

6 5 3
m(C6H5OH)=0,006 * 94=0,564 г
3) 1,2 – реакцияларға қатысқан NaOH-тың мөлшерін анықтау қажет. 0,4М NaOH берілген, сондықтан:
m(NaOH)=0,4*40=16 г
1000 мл ерітіндіде 16 г NaOH бар
100 мл х NaOH
x=m(NaOH)=1,6 г
4) 2-ші теңдеу бойынша
n (NaOH ) = 1,6
 40
40
= 0,04 моль
а моль NaOH СН3СООН әрекеттеседі; в моль NaOH С6Н5ОН әрекеттеседі;
а + в = 0,04 моль
Сонда 2-ші теңдеу бойынша:
|
|
|
1 моль С6Н5ОН------ 1 моль NaOH
0,006 моль С6Н5ОН------ х
x=a(NaOH)=0,006 моль NaOH
в=0,04 – 0,006 = 0,034 моль NaOH CH3COOH-пен 1-ші теңдеу бойынша әрекеттеседі.
5) сонда 1- ші теңдеу бойынша:
1 моль СН3СООН 1 моль NaOH
х------- 0,034 моль NaOH
х = ν(CH3COOH) = 0,034 моль m(CH3COOH)=n*M2(CH3COOH)=0,034*60=2,04 г
6) фенол мен сірке қышқылының массалық үлестері:
w (C H3C OO H ) =
2,04

5
* 100 %
= 40,8 %
w (C6
H OH ) = 0,564 * 100 % =11,28 %
 5 5
5 5
Жауабы: 40,8% пен 11, 28%
Есеп №3
Көлемі 500 мл ерітіндіде жалпы массасы 13,7 г қымыздық және құмырысқа қышқылдары бар. Осы ерітіндінің 50 мл-дегі қышқылдарды тотықтыру үшін 1,58 г калий перманганаты жұмсалған. Ерітіндідегі қышқылдардың молярлық концентрациясын есептеңіз.
Шешуі:
1) жүйеде төмендегі реакциялар жүреді:
2KMnO4 + 5H2C2O4 + 3H2SO4=10CO2 + K2SO4 + 2MnSO4 + 8H2O (1)
2KMnO4 + 5HCOOH + 3H2SO4=K2SO4 + 2MnSO4 + 5CO2 + 8H2O (2)
2) есеп мазмұны бойынша:
|
m (K M nO4 )

= 1,58 = 0,01 моль ;
M (K M nO4 )
158
Реакцияға қатысқан Н2С2О4 пен НСООН массасы:
500 мл------- 13,7 г
50 мл------- х
 x = 50 * 13,7 = 1,37 г
x = 50 * 13,7 = 1,37 г
500
3) 1,2 – ші теңдеулер бойынша:
2 моль KMnO4 ----- 5 моль Н2С2О4 әрекеттеседі; 2 моль KMnO4--------------------- 5 моль HCOOH әрекеттеседі;
|
|
|
яғни теңдеу бойынша:
4 моль KMnO4-------- 10 моль қышқыл
0,01----- х
x = 0,01*10

= 0,025
Моль
(H C O
+ HCOOH )
4
а – деп Н2С2О4 – тің моль санын белгілісе;
в – деп HCOOH – тың моль санын белгілісе; сонда, а + в = 0,025
2 2 4
ал, М(H2C2O4)=90; M(HCOOH)=46; m(H2C2O4)=a*90; m(HCOOH)=в*46;
90 * а + 46 * в = 1,37
немесе
в = 0,02 моль НСООН
90 (0,025 – в) + 46 в = 1,37
2,25 – 90 в + 46 в = 1,37
0,88 = 44 в
а = 0,025 – 0,02 = 0,005 моль Н2С2О4
4) сонымен,
50 мл------- 0,02 моль НСООН болған
500 мл------- х
х = 0,2 моль НСООН
50 мл ------- 0,005 моль Н2С2О4 болғаны 500 мл--------------- х
 x = 0,005* 500 = 0,05 моль
x = 0,005* 500 = 0,05 моль
50
5) молярлық концентрацияны анықтау үшін 1 л неше моль болғанын анықтау қажет: Н2С2О4 : 500 мл------- 0,05 моль
1000 мл------- х
 x = 1000* 0,05
x = 1000* 0,05
500
= 0,1 M
НСООН : 500 мл------- 0,2 моль
1000 мл------- х
Жауабы: 0,1 М және 0,4 М
x = 1000* 0,2
 500
500
= 0,4 M
4.12 Өзіндік орындауға арналған тапсырмалар
1. Әлдебір бірнегізді қышқылдың 14,8 г натрий гидрокарбонатымен әрекеттескенде бөлінген газды әк суынан өткізгенде массасы 20 г тұнба түзілген. Қышқылдың формуласын анықтаңыз.
2. Массасы 24 г қаныққан бірнегізді карбон қышқылын декарбоксилирлеу реакция нәтижесінде 8,96 л (қ.ж.) газ бөлінген. Қышқылдың формуласын анықтаңыз.
|
|
|
3. Массасы 17,6 г қаныққан бірнегізді карбон қышқылын декарбоксилирлеу реакция нәтижесінде 8,8 г газ бөлінген. Қышқылдың формуласын анықтаңыз.
4. Құрамында 96% қоспасы бар көлемі 500 л (қ.ж.) метаннан құмырысқа қышқылының қандай массасын алуға болады. Өнім шығымы 75%.
Жауабы: 738,3 г
5. Көлемі 8,96 л (қ.ж.) бутанды тотықтыру нәтижесінде 85% - ды сірке қышқылының қандай массасын алуға болады. Өнім шығымы 70%.
Жауабы: 39,5 г
6. Сірке қышқылы кальций карбидінен үш сатылы әдіспен алынады. Құрамында 10% қоспасы бар массасы 71,1 г кальций карбидінен сірке қышқылының қандай массасын алуға болады? Өнім шығымы бірінші сатыда 90%, екіншіде - 80%, үшіншіде – 75%.
Жауабы: 32,4 г
7. Массасы 18,0 г пропанол – 1 тотықтыру нәтижесінде түзілген қышқылды бейтараптандыру үшін 111,1 мл 11%, тығыздығы 1,1 г/мл калий гидроксиді ерітіндісі жұмсалған. Қышқылдың шығымын есептеңіз.
Жауабы: 80%
8. Әлдебір карбон қышқылының сутек бойынша тығыздығы 37 тең. Осы қышқылдың 59,2 г бейтараптандыру үшін 10,1% тығыздығы 1,11 г/мл натрий гидроксиді ерітіндісінің қандай көлемі қажет?
|
|
|
Жауабы: 285,4 мл
9. Массасы 200 г құмырысқа қышқылы ерітіндісі мыс (ІІ) гидроксидімен әрекеттескенде 14,4 г тұнба түзілген. Бастапқы ерітіндіде құмырысқа қышқылының м.ү. есептеңіз.
Жауабы: 2,3%
10. Массасы 60 г құмырысқа қышқылы ерітіндісін күміс (І) оксидінің аммиак ерітіндісінен жібергенде түзілген газды әк суымен сіңіргенде массасы 30 г тұнба түзілген. Бастапқы ерітіндідегі қышқылдың м.ү. есептеңіз.
Жауабы: 23%
11. Массасы 200 г 4,6% құмырысқа қышқылы ерітіндісі күміс (І) оксидінің аммиак ерітіндісімен әрекеттескенде түзілетін тұнбаның массасын есептеңіз. (Өнім шығымы 85%)
Жауабы: 34,7 г
12. Құмырысқа және сірке қышқылдар қоспасын бейтараптандыру үшін 165,3 мл 14,6% тығыздығы 1,16 г/мл натрий гидроксиді ерітіндісі жұмсалған. Дәл осындай үлгіге күміс (І) оксиді ерітіндісімен әcер еткенде 86,4 г тұнба түзілген. Қоспа құрамын анықтаңыз.
Жауабы: 50,5%; 49,5%
13. Құрамында 3 г сірке қышқылы және 4,6 г құмырысқа қышқылы бар қоспаны бейтараптандыру үшін 5,1%, тығыздығы 1,06 г/ мл натрий гидроксиді ерітіндісінің қандай көлемі қажет болады?
Жауабы: 111 мл
14. Массасы 15,4 г сірке қышқылы мен құмырысқа қышқылы қоспасын
бейтараптандыру үшін 107 мл 10,1% тығыздығы 1,11 г/мл натрий гидроксиді ерітіндісі жұмсалған. Қоспа құрамын анықтаңыз. Жауабы: 60,53%; 39,47%
15. Массасы 16,6 г этил спирті мен бірнегізді карбон қышқылы қоспасына натриймен әсер еткенде 3,36 л (қ.ж.) газ бөлінген. Үлгінің дәл осындай массасына натрий
карбонатымен әсер еткенде 2,24 л (қ.ж.) газ бөлінген. Қышқылдың формуласын және қоспа құрамын анықтаңыз.
Жауабы: 27,7%; 72,3%
16. Мына тізбектерді іске асыру реакцияларын жазыңыз:
1) 𝐶𝐻4 → 𝐶𝐻3𝐵𝑟 → 𝐶2𝐻6 → 𝐶2𝐻4 → 𝐶2𝐻6𝑂 → 𝐶2𝐻4𝑂 → 𝐶2𝐻4𝑂2 → 𝐶3𝐻6𝑂2
2) 𝐶𝑎𝐶2 → 𝐶2𝐻2 → 𝐶2𝐻4𝑂 → 𝐶2𝐻3𝑂2𝑁𝑎 → 𝐶𝐻4 → 𝐶𝑂2
3) алюминий карбиді → 𝐶𝐻4 → 𝐶2𝐻2 → 𝐶2𝐻4𝑂 → 𝐶2𝐻5𝑂 → 𝐶3𝐻6𝑂2
17. Мына тізбектерді іске асыру реакцияларын жазыңыз:
2𝐾𝑂𝐻
𝐻2𝑂
𝐻𝐶𝑁
𝐻2𝑆𝑂4
𝐻𝐵𝑟
1) 𝐶𝐻2𝐵𝑟 − 𝐶𝐻2𝐵𝑟
→ 𝐴
𝐶2𝐻5𝑂𝐻
→ Б
𝐻𝑔2+
→ 𝐵
𝐾𝐶𝑁
→ 𝐷 → 𝐸
𝑡
𝐶𝑙2
𝑁𝑎𝑂𝐻
[𝑂]
[𝑂] 𝑡
2) 𝐶𝐻4 → 𝐴 →
𝐵 → 𝐷 → 𝐾
→ 𝐸
ℎ𝑣 𝐻2𝑂
18. Мына тізбектерді іске асыру реакцияларын жазыңыз:
1) метан → ацетилен → этаналь → сірке қышқылы → натрий ацетаты → метан;
2) кальций карбиді → ацетилен → сірке альдегиді → сірке қышқылы → натрий ацетаты → метан → метилхлориді → этан → этилен → этанол → сірке қышқылы → метилацетаты;
3) алюминий карбиді → метан → метилбромид → этан → этилен → этанол → сірке қышқылы → натрий ацетаты → метан → ацетилен → сірке альдегиді → этанол → диэтил эфирі.
19. Бес пробиркада: бензол, сірке қышқылы, формалин, этиленгликоль, карбон қышқылы бар. Пробиркадағы қосылыстарды ажыратып, реакцияларын жазыңыз.
20. Төрт пробиркада: сірке қышқылы, құмырысқа қышқылы, глицерин, су бар. Пробиркадағы қосылыстарды ажырату реакцияларын атап, жазыңыз.
21. Төрт пробиркада: сірке қышқылы, формалин, этиленгликоль, бензол бар. Пробиркадағы қосылыстарды ажырату реакцияларын анықтап, жазыңыз.
4.13 
 Эфирлер
Эфирлер
 |
 |
 |
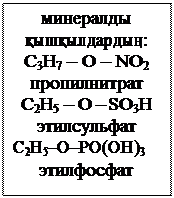

4.13.1  Жай эфирлер
Жай эфирлер
Жай эфирлер – екі көмірсутек радикалы өзара оттек арқылы байланысқан органикалық қосылыс: R – O – R1
Аталуы
Оттек арқылы байланысқан көмірсутектердің аттары бойынша аталады. Мысалы: СН3 – О – СН3 – диметил эфирі; метоксиметан
С2Н5 – О – С2Н5 – диэтил эфирі; метоксиэтан
СН3 – О – С2Н5 – метилэтил эфирі; метоксиэтан
Жүйелік номенклатура бойынша алкокситобымен (R–O–) байланысқан көмірсутек атымен аталады. Мысалы:
2 1
СН3 – СН2 – О – СН – СН3
3|
СН3
2 – этоксипропан
1 2 3 4
СН3 – О – СН2 – СН – СН2 – СН3
| СН3
1– метокси – 2 – метилбутан
Изомериясы
1. Оттекпен байланысқан радикалдардың изомериясына байланысты болады: СН3 – О – СН2 – СН2 – СН3 – 1 – метоксипропан; метил пропил эфирі СН3 – СН2 – О – СН2 – СН3 – этоксиэтан;диэтил эфирі
 СН3
СН3
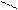 СН3 – О – СН – 2 – метоксипропан; метилизопропил эфирі
СН3 – О – СН – 2 – метоксипропан; метилизопропил эфирі
СН3
Алу әдістері
Табиғатта бос күйінде кездеспейді. Оларды химиялық әдіспен алады.
1. Екі молекула спирттен H2SO4 қатысында:
 С2Н5 – О Н + НО – С2Н5 → С2Н5 – О – С2Н5 + Н2О
С2Н5 – О Н + НО – С2Н5 → С2Н5 – О – С2Н5 + Н2О
2. Al2O3 қатысында 2500С суды тартып алу:
2С2Н5ОН → С2Н5 – О – С2Н5 + Н2О
3. Алкоголяттардың галогентуындыларымен әрекеттесу нәтижесінде:
С2Н5ОNa + J – СН3 → С2Н5О – СН3 + NaJ
Физикалық қасиеттері
1. СН3ОСН3 және СН3 – О – С2Н5 – газдар.
2. С2Н5ОС2Н5 бастап сұйықтар.
3. Судан жеңіл, суда нашар ериді.
4. Органикалық еріткіштерде ерігіштігі жоғары.
Дата добавления: 2021-03-18; просмотров: 254; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
