Фишер формуласы Колли-Толленсу формуласы 6 страница
О
4 3 2 1 // СН3 – СН – СН2 – С
| \
СН3 ОН
3 – метилбутан қышқылы
Изомерия
1. Көмірсутектің қаңқасы.
2. Класаралық карбон қышқылдары – күрделі эфирлер.
Алу әдістері
1. Альдегидтерді тотықтыру (зертханалық әдіс):
О О
// [O] //
СН3 – С → СН3 – С
\ \
Н ОН
Тотықтырғыштар ретінде күміс (І) иондарының аммиак ерітіндісі, мыс (ІІ) оксиді қолданылады.
2. Кетондарды тотықтыру (зертханалық әдіс):
[𝑂]
Н3С – С – СН3 → НСООН + СН3 – СООН
|| құмырсқа сірке
О қышқылы қышқылы
Тотықтырғыш ретінде KMnO4, K2Cr2O7 + H2SO4 қолданылады. Попов ережесі бойынша түрлі қышқылдар түзіледі.
3. Алкандарды тотықтыру (өндірістік әдіс):
2СН3 – СН2 – СН2 – СН3 + 5О2 → 4СН3СООН + 2Н2О
Катализатор: марганец, кобальт тұздары
4. Спирттерді тотықтыру:
2СН3 – СН2 – СН2 – СН2 – ОН + 2О2 → 2СН3 – СН2 – СН2 – СООН +2Н2О
май қышқылы (бутан қышқылы)
Тотықтырғыштар: KMnO4 + H2SO4
5. Алкендерді тотықтыру:
СН3 – СН = СН – СН2 – СН3 → СН3СООН + СН3СН2СООН
Тотықтырғыштар: KMnO4 + H2SO4
6. Алкендердің көміртек (II) оксидімен су буында катализатор қатысында (оксо- синтез):
|
|
|
СН3 – СН = СН2 + СО + Н2О → СН3 – СН2 – СН2 – СООН
пропилен бутан қышқылы
(май қышқылы)
Катализатор рөлін H2SO4, H3PO4 немесе Ni(CO)4 атқарады. Реакция жоғары температура және жоғары қысымда жүргізіледі.
7. Галоген туындыларын гидролиздеу реакциясымен:
CH3 – CH2 – CH2Cl → CH3 – CH2 – CH2OH + NaCl CH3 – CH2 – CH2OH → CH3 – CH2 – COOH + Н2О
8. Майларды гидролиздеу нәтижесінде:
| CH2 – O – CO – R1 | CH2 – OH | R1COOH | |||
| | | | | ||||
| CH – O – CO – R2 | + | HOH → | CH – OH | + | R2COOH |
| | | | | ||||
| CH2 – O – CO – R3 | CH2 – OH | R3COOH |
Сілтілік ортада тепе – теңдік оңға ығысады.
Физикалық қасиеттері
1. HCOOH, CH3COOH, CH3CH2COOH – сұйықтықтар, суда жақсы ериді, өткір иісті;
2. C4 – C8 қоймалжың сұйықтықтар, суда нашар ериді; өткір иісті;
3. C9H19COOH-нан бастап қатты заттар, суда ерімейді, иісі жоқ;
4. Карбон қышқылдары сутекті байланыс нәтижесінде димер түзеді:
О. Н – О
/ \
R – С С – R
\ /
О – Н О
Сондықтан олардың қайнау, балқу температурасы жоғары.
|
|
|
Химиялық қасиеттері
Химиялық қасиеттері карбон қышқылдардың электрондық құрылысымен түсіндіріледі. Карбон қышқылында карбонил тобындағы оттектің электртерістігі жоғары болғандықтан радикал бойындағы электрондық бұлт карбонил тобындағы оттекке қарай ығысады.
 |
O←H тобының да поляризациясы өседі, осының әсерінен карбоксил тобындағы сутектің диссоциациясы артады.
OH – – тобындағы сутек ионының орынбасу реакциялары:
1)
|
Н+ немесе
ОН О─
| О | О | |||
| // R – С | + | Н2О | → | // R – С + Н3О+ |
| \ | \ |
ОН О─
2) карбон қышқылдарына барлық қышқылдардың қасиеті тән: а) металдармен әрекеттеседі:
2CH3COOH + 2Na → 2CH3COONa + H2
натрий ацетаты
ә) сілтілермен:
CH3COOH + NaOH → CH3COONa + H2O
б) металл оксидтерімен:
2CH3COOH + CaO → Ca(CH3COO)2 + H2O
в) тұздармен:
2CH3COOH + CaCO3 → Ca(CH3COO)2 + H2O + CO2
Сонымен қатар қышқылда радикалмен байланысқан көміртек атомында оң зарядтың мөлшері басым болады, сондықтан OH – – тобы орынбасу реакцияға түсу қабілетіне ие болады.
|
|
|
𝑂𝐻− − тобының орынбасу реакциялары:
1) cпирттермен әрекеттесіп (этерификация реакциясы) күрделі эфирлер түзеді:
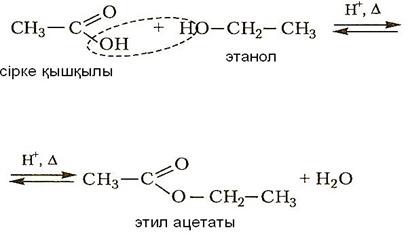 |
2) екі молекуласы бір-бірімен әрекеттесіп ангидрид түзеді:
О
//
О О СН3 – С
// \\ \
СН3 – С + С – СН3 → О + Н2О
\ / /
ОН НО СН3 – С
\\ О
сірке ангидриді
Катализатор: P2O5, t
3) фосфор галогенидімен әрекеттесіп хлорангидрид түзеді:
| О // СН3 – С \ ОН | + PCl5 |
→ | О // СН3 – С + РОCl3 + НCl \ Cl хлорангидрид | |
| О // НС \ формил |
Н3С – С
ацетил | О // \ | О // С2Н5 – С – радикалдары \ пропионил | |
Алкил тобындағы орынбасу реакциялары:
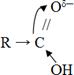 Карбон қышқылдарында
Карбон қышқылдарында
тобының әсерінен R радикалындағы СН3 -
тобында сутектің қозғалғышы артады, сондықтан олар Cl2,Br2 орынбасу реакциясына жеңіл қатысады.
|
|
|
| О | О | |||
| // | // | |||
| Н – СН2 – СН2 – С | + | Cl – Cl | → | Cl – СН2 – СН2 – С + НCl |
| \ | \ | |||
| ОН | ОН | |||
| 3 – хлорпропан қышқылы |
Карбон қышқылындағы галоген атомы қышқылдың қышқылдық қасиетін жоғарылатады, себебі галогендердің электртерістігі жоғары, соның нәтижесінде электрондық бұлт хлор – атомына қарай ығысып, гидроксил тобындағы сутек атомының қозғалғыштығын жоғарлатады, яғни қышқылдық қасиеті артады.
Қышқылдық қасиет мына қатар бойынша артады:
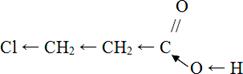 |
Тотықсыздану реакциялары:
J → Br → Cl → F
О О
// //
СН3 – С + H2 → СН3 – С + H2 → CH3 – CH2OH + H2O
\ \
ОН Н
Тотығу реакциялары
Карбонқышқылдары жанады:
СH3COOH + 2O2 = 2CO2 + 2H2O
4.10.1 Құмырсқа қышқылы
Құмырсқа қышқылы (НСООН) – өткір иісті, түссіз сұйықтық. Суда кез-келген қатынаста ериді. Құмырсқаның бездерінде, жеміс-жидектерде, нәр және тер құрамында кездеседі.
Химиялық қасиеттері
Оның екі түрлі құрылысы бар:
О О
// //
Н – С НО – С
\ \
ОН Н
карбоксил тобы карбонил тобы
Сондықтан оған қышқылдардың және альдегидтердің қасиеттері тән. Диссоциациясы былайша жүреді: НСООН → НСОО─ + Н+
Қышқылдар қасиеттері алдында сипатталды.
НСООН күміс айна реакциясын береді (басқа қышқылдардан айырмашылығы):
HCOOH + Ag2O → 2Ag + CO2 + H2O HCOOH + 2Cu(OH)2 → CO2 + 3H2O + Cu2O
қызыл тұнба
Қыздырғанда ыдырайды.
НСООН → СО + Н2О немесе 1600С температурада НСООН → СО2 +Н2, реакция күкірт қышқылы қатысында жүреді.
Алу әдістері
О
// СО + NaOH → Н – С
\ ОNa
НСООNa + H2SO4 → НСООН + NaНSO4
Қолданылуы
1) органикалық синтезде тотықсыздандырғыш ретінде;
2) қымыздық қышқылын (Н2С2О4) алу үшін;
3) тағамдар өндірісінде;
4) маталарды бояу үшін;
5) медицинада.
4.10.2 Сірке қышқылы
СН3СООН – өткір иісті, түссіз сұйықтық, суда кез-келген қатынаста ериді, қатады. 70-80% – сулы ерітіндісі сірке эссенциясы деп аталады. 3-9% - сулы ерітіндісі – асхана уксусы деп аталады. Табиғатта кездеседі. Нәр, тер, өсімдіктерде кездеседі.
Химиялық қасиеттері
Химиялық қасиеттері әлсіз минералдық қышқылдарға ұқсайды:
1) диссоциацияланады: СН3СООН → СН3СОО─ + Н+
2) металдармен, металл оксидтерімен, гидроксидтерімен, карбонаттармен (Na2СО3, СаСО3) әрекеттеседі;
3) барлық алдында көрсетілген органикалық қышқылдардың қасиеттері тән.
1. Кучеров реакциясымен алады:
Алу әдістері
О О
// //
НС ≡ СН + Н2О → СН3 – С → СН3 – С
\ \
Н ОН
альдегид қышқыл
Катализатор: HgSO4 , Hg(NO3)2
2. Бутанды тотықтыру:
О
//
2СН3 – СН2 – СН2 – СН3 + 5О2 → 4СН3 – С + 2 Н2О
\ ОН
3. Метаннан алады, реакция көп сатылы жүреді:
2СН4 → С2Н2 → СН3СОН → СН3 – СООН
Қолданылуы
1) пластмассалар алады;
2) бояу, ацетат талшығын, дәрі – дәрмек;
3) мата, тері өндірісінде, түрлі тұздарын( Al,Cr) пайдаланады;
4) тағамдар өндірісінде;
5) ауылшаруашылық зиянкестерімен күресте.
Көп кездесетін қышқылдар
Қаныққан, қатты:
С15Н31СООН – пальмитин; С17Н35СООН – стеарин;
Қанықпаған, сұйық:
С17Н33СООН – олеин (бір қос байланыс),
С17Н31СООН – линол (екі қос байланыс), С17Н29СООН – линолен. Н2С = СН – СООН – акрил (пропен қышқылы)
СН3 – СН = СН – СООН – кротон (бутен-2 қышқылы)
Екі негізді карбон қышқылдары
Қаныққан:
НООС – СООН – қымызыдық (этандион қышқылы); НООС – СН2 – СООН – малон (пропандион қышқылы); НООС – (СН2)2 – СООН – янтарь (бутандион қышқылы); НООС – (СН2)3 – СООН – глутар (пентандион қышқылы); НООС – (СН2)4 – СООН – адипин (гександион қышқылы); Қанықпаған:
НООС – НС = СН – СООН – малеин (бутендион қышқылы);
4.11 Карбон қышқылдары тақырыбына арналған есептерді шығару әдістемесі
Есеп №1
Сірке қышқылының құрамында сірке альдегиді мен этанол қоспалары бар. Осы үлгінің 20г аммиак ерітіндісіндегі күміс оксидімен өңделген, реакция нәтижесінде 13,5г тұнба түзілген.Үлгінің дәл осы массасын бейтараптандыру үшін 25,65 мл массалық үлесі 30% (ρ=1,3 г/см3) натрий гидроксиді ерітіндісі жұмсалған. Үлгі құрамын анықтаңыз.
Шешуі:
1) есеп мазмұны бойынша жүйеде мына реакциялар жүреді:
CH3CHO + Ag2O → 2Ag + CH3COOH (1)
CH3COOH + NaOH → CH3COONa + H2O (2)
2) күмістің мөлшері:
n (Ag )
= m (Ag)
= 13,5 = 0,125 моль
M (Ag)
108
3) сірке альдегидінің мөлшері мен массасы:
СН3 СНО------ 2А
1 моль------- 2 моль
х------- 0,125 моль
 x = 0,125
x = 0,125
2
= 0,0625
моль
m(CH3CHO)=nM(CCH3CHO)=0,0625*44=2,75 г
4) реакцияға қатысқан NaOH мөлшері:
100 г------- 30 г
25,65 * 1,3------- х
 x = 30 * 25,65 * 1,3
x = 30 * 25,65 * 1,3
100
= 10,0 г
n (NaOH )
= 10 г
 40 г / моль
40 г / моль
= 0,25 моль
СН3 СООН------ NaOH
1 моль------- 1 моль
х-------- 0,25 моль
х = 0,25 моль
m(CH3COOH) = 0,25*60 = 15,0 г
Этанолдың массасы: m(C2H5OH) = 20 – 15 – 2,75 = 2,25 г
5) массалық үлестерін есептеу:
1) w (CH COOH ) = 15 * 100 % = 75,00 % ;

2) w
3
(C H3C H O) =
20
2,75

Дата добавления: 2021-03-18; просмотров: 133; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
