Глава 13. МУТАЦИОННАЯ ИЗМЕНЧИВОСТЬ
В главах 6, 7, 9 шла речь о наследственной изменчивости, возникающей в результате комбинаций генов и их взаимодействия, т. е. о комбинативной изменчивости. При этом сами гены не изменялись, менялось их сочетание и характер взаимодействия в системе генотипа. Поэтому данный тип наследственной изменчивости следует рассматривать как вторичное явление, а первичным явлением — источником нового — следует считать мутационное изменение гена.
Термин «мутация» впервые был предложен Г. Де Фризом в его классическом труде «Мутационная теория» (1901—1903). Мутацией он назвал явление скачкообразного, прерывистого изменения наследственного признака. Многочисленные примеры скачкообразных изменений различных признаков, наследующихся в ряду последовательных поколений, были известны еще Ч. Дарвину. Он называл их неопределенными изменениями и придавал им большое значение в эволюции. Однако теория мутаций была сформулирована позже Де Фризом. До сих пор не утратили своего значения основные положения его теории:
1) мутация возникает внезапно, без всяких переходов;
2) новые формы вполне константны, т. е. устойчивы;
3) мутации являются качественными изменениями;
4) мутации происходят в разных направлениях, они могут быть как полезными, так и вредными;
5) одни и те же мутации могут возникать повторно.
Однако Де Фриз допустил принципиальную ошибку, противопоставив теорию мутации теории естественного отбора. Он неправильно считал, что мутации могут сразу давать новые виды. На самом деле мутации являются лишь источником наследственных изменений, служащих материалом для длительного отбора, результатом которого может быть возникновение
нового вида.
Но нельзя не восхищаться научным предвидением Де Фриза в отношении значения основных положений мутационной теории для эволюции и селекции.
I. ПРИНЦИПЫ КЛАССИФИКАЦИИ МУТАЦИЙ
Типы мутаций. Мутационный процесс условно делят на спонтанный и индуцированный. В тех случаях, когда мутации возникают под влиянием обычных природных факторов внеш-
193
 ней среды или в результате нормальных физиологических и биохимических изменений в самом организме, их относят к спонтанным. Мутации, возникающие под влиянием специальных воздействий (ионизирующей радиации, химических веществ, температуры и т. д.), называют индуцированными. Принципиальных различий между спонтанными и индуцированными мутациями нет, но изучение последних подводит генетиков к овладению наследственной изменчивостью и разгадке тайны строения и функционирования гена.
ней среды или в результате нормальных физиологических и биохимических изменений в самом организме, их относят к спонтанным. Мутации, возникающие под влиянием специальных воздействий (ионизирующей радиации, химических веществ, температуры и т. д.), называют индуцированными. Принципиальных различий между спонтанными и индуцированными мутациями нет, но изучение последних подводит генетиков к овладению наследственной изменчивостью и разгадке тайны строения и функционирования гена.
По месту возникновения мутации делятся на генеративные (в половых клетках) и соматические (в клетках тела).
Мутации можно также классифицировать по тем признакам и свойствам, которые они определяют, т. е. по фенотипу, и по характеру изменений в генотипе. Различают мутации и по их адаптивному значению.
До сих пор нет хорошей классификации мутаций; все имеющиеся классификации искусственны и схематичны.
Генеративные и соматические мутации. Мутации могут возникать в клетках любых тканей многоклеточного организма и на любых стадиях его развития. Мутации, возникающие в незрелых и зрелых половых клетках, называют генеративными, а в клетках других тканей — соматическими.
Соматические мутации по своей природе ничем не отличаются от генеративных. Необходимость такого разделения вызвана тем, что эволюционная ценность генеративных и соматических мутаций различна и определяется типом размножения организма. Различие генеративных и соматических мутаций состоит также в проявлении и методах их обнаружения.
Мутации обнаруживаются в половых клетках в тех случаях, если они определяют их морфологические и физиологические особенности. Так, например, у крупного рогатого скота известны гены, определяющие аномалии в строении сперматозоида: эксцентричное расположение хвостика, изгиб головки и др. Мутации, вызывающие изменение признаков и свойств организма, могут быть обнаружены, если гамета, несущая мутантный ген, участвует в образовании зиготы, т. е. передается следующему поколению. Если мутация доминантна, то новый признак или свойство проявляется даже у гетерозиготного организма, происшедшего из этой гаметы; если мутация рецессивна, то мутантный ген может не проявить своего действия в течение нескольких поколений, сохраняясь в гетерозиготном состоянии. Появление нового признака возможно только при переходе рецессивного гена в гомозиготное состояние (в F2, F3 и т. д.).
Если генеративная мутация возникает в клетке на ранней стадии зачаткового пути или в период размножения спермато-гониев и оогониев, то мутантный ген размножится в количестве, пропорциональном числу прошедших клеточных делений, В этом
случае часть половых клеток будет мести одинаковую мутацию («пучок» идентичных мутаций), у остальных клеток генотип останется неизменным. Мутация, возникшая на стадии сперматозоида или яйцеклетки, останется единичной.
Соматическая мутация проявляется мозаично. Особи, несущие участки мутантной ткани, называют мозаиками или химерами. Чем раньше в онтогенезе возникает соматическая мутация, тем большим оказывается участок ткани, несущий данную

мутацию, и чем позднее — тем мень- 82.
ШИМ. В силу диплоидности набора хро- Соматическая мутация (тем-
мосом в клетках соматической ткани ное пятно) окраски шерст-
проявление мутации возможно только ного покрова у каракуль-
в тех случаях, когда мутантная аллель ской овчы<
оказывается доминантной или рецессивной, но только в гомозиготном состоянии. На рисунке 82 показана соматическая мутация окраски шерстного покрова у овцы: черное пятно возникло на фоне коричневой окраски. Подобные явления иногда встречаются у растений, животных и человека.
У организмов, размножающихся исключительно половым путем, характеризующихся ранним обособлением зачаткового пути, соматические мутации не играют роли в эволюции и не представляют какой-либо ценности для селекции. Но у организмов с бесполым размножением соматические мутации могут иметь огромное значение и в эволюции, и в селекции. Так, например, у вегетативно размножаемых плодовых и ягодных растений любая соматическая мутация может дать растения и целый клон
194
195
 с новым Мутантным признаком. Одним из видов соматических мутаций у растений являются почковые мутации, возникающие в меристемных клетках точки роста стебля. В этом случае весь побег, развившийся из этой клетки, будет нести мутантный признак. Почковые мутации были известны давно и назывались спортами.
с новым Мутантным признаком. Одним из видов соматических мутаций у растений являются почковые мутации, возникающие в меристемных клетках точки роста стебля. В этом случае весь побег, развившийся из этой клетки, будет нести мутантный признак. Почковые мутации были известны давно и назывались спортами.
Исследование соматических мутаций в настоящее время приобретает важное значение для изучения причин возникновения рака у человека и животных. Предполагают, что для ряда злокачественных опухолей превращение нормальной клетки в раковую происходит по типу соматических мутаций (см. гл. 30).
Классификация мутаций по фенотипу. Поскольку генотип определяет последовательную цепь процессов при развитии ор-
|
|
83.
Мутация коротконогое™ у овцы. Справа и в центре — баран и овца коротконогие, слева — овца с нормальными ногами.
ганизма, т. е. морфологическую, физиологическую и биохимическую дифференциацию тканей и составляющих их клеток, то очень важна классификация мутаций по их действию. Мутации условно делят на морфологические, физиологические и биохимические.
Морфологические мутации (часто их называют видимыми) связаны с изменением в строении или свойствах органов, тканей или отдельных структур клетки. К ним относятся, например, коротконогость у ряда сельскохозяйственных животных — крупного рогатого скота, овец и др. (рис. 83), безглазость и бескрылость у насекомых, бесшерстность у млекопитающих, неопушен-ность различных органов у растений, гигантизм, карликовость, альбинизм у человека и др.
Мутации могут оказывать действие на внутриклеточные структуры и процессы: на поведение хромосом в мейозе, на клеточное деление. Так, например, у кукурузы обнаружена мутация, которая обусловливает отсутствие конъюгации гомологичных хромосом в мейозе, другая вызывает слипание хромосом в метафазе в сплошную массу (типа пикноза), третья приводит к задержке цитокинеза вследствие нарушения ахроматинового
196
аппарата. Эти факты показывают, что поведение самих хромосом также контролируется генотипом.
У различных организмов известно большое количество физиологических мутаций, вызывающих изменения физиологических процессов. Типичным примером может быть мутация, вызывающая у мышей круговые, «вальсирующие» движения. Большинство физиологических мутаций изменяет жизнеспособность особей.
К биохимическим мутациям относятся мутации, изменяющие качественно или количественно синтез определенных химических веществ в организме. Благодаря этим мутациям изменяется обмен веществ организма и как следствие его химический состав и потребности в тех или иных химических веществах. Наиболее
84
ы ' Фенилаланин н---- *■ Тирозин Ч------- *■ Меланин
Схема фенилаланин- I з \ '
тирозинового обмена 1 \^
у человека: ФенилпироВиноградная ГомогентизиноВая
1—3—места блокирования кислота кислота
биохимических реакции у
при различных мутациях; 2 \,
/ — альбинизма, 2 — ал- + u n
каптоиурни, 3 —феиилке- LUZ + H2U
тонурии.
хорошо они изучены у микроорганизмов. Многие мутанты (их называют ауксотрофами) не развиваются без введения в среду некоторых недостающих им веществ, в отличие от прототро-фов — организмов дикого типа, способных синтезировать все необходимые для своего роста вещества и растущих на минимальных средах, содержащих только минеральные соли и углеводы (см. гл. 15).
Классификация мутаций по фенотипу, т. е. по их проявлению, очень условна. В действительности в основе проявления всех мутаций всегда лежат изменения биохимических процессов. Рассмотрим конкретный пример. Организму человека для нормального обмена веществ необходимы такие аминокислоты, как фенилаланин и тирозин. Он получает их обычно из белков пищи, а тирозин, кроме того, синтезируется из фенилаланина. В организме тирозин участвует в цепи биосинтеза многих белков, некоторых гормонов (тироксина, норадреналина и др.), меланина или распадается до С02 и Н20. Фенилаланин также участвует в синтезе белков, как уже упоминалось, в образовании тирозина или превращается в фенилпировиноградную кислоту (рис. 84). Однако если вследствие мутации блокируется одно из звеньев цепи биосинтеза меланина, то в меланоцитах не вырабатывается пигмент. Обнаруживается такая мутация по отсутствию пигмента в волосах, коже, глазах и называется мутацией альбинизма. Она может быть отнесена к числу видимых, или морфологических, мутаций.
197
 У людей, больных алкаптонурией, моча на воздухе чернеет. Биохимический анализ показал, что это происходит благодаря окислению гомогентизиновой кислоты. Причиной наличия го-могентизиновой кислоты в моче больных является мутация, которая называется по своему проявлению биохимической и связана с блокировкой цепи биохимических реакций на стадии гомогентизиновой кислоты. У нормальных людей эта цепь реакций заканчивается образованием С02 и Н20.
У людей, больных алкаптонурией, моча на воздухе чернеет. Биохимический анализ показал, что это происходит благодаря окислению гомогентизиновой кислоты. Причиной наличия го-могентизиновой кислоты в моче больных является мутация, которая называется по своему проявлению биохимической и связана с блокировкой цепи биохимических реакций на стадии гомогентизиновой кислоты. У нормальных людей эта цепь реакций заканчивается образованием С02 и Н20.
Некоторые виды слабоумия, как показывают генетические исследования, также обуславливаются мутационными изменениями генов. По проявлению их можно отнести к числу физиологических. Однако биохимические анализы показали, что, например, один из видов умственной неполноценности — фенил-кетонурия — связан с нарушением синтеза тирозина из фенила-ланина и накоплением в связи с этим фенилпировиноградной кислоты, которая блокирует цепи ряда реакций и в конечном счете является причиной слабоумия.
Из этих примеров становится ясно, насколько условно деление мутаций по фенотипу, ведь в основе всех рассмотренных изменений лежат изменения в цепи биохимических превращений.
Условность этой классификации становится еще более очевидной, если учесть, что большинство генов обладает плейотроп-ным эффектом. Поясним это на том же примере. Как уже было сказано, фенилкетонурия связана со слабоумием. Однако наблюдения показывают, что у таких людей постоянно наблюдается ослабление пигментации (изменение морфологического признака), в моче их присутствует фенилпировиноградная кислота (откуда происходит и название болезни — фенилкетонурия). В крови больных отсутствует фермент, обеспечивающий синтез тирозина из фенилаланина, что и является, очевидно, первичным дефектом обмена. Гормональная система таких больных бывает также ненормальной как следствие угнетения некоторых цепей реакций накапливающимися продуктами нарушенного обмена.
Классификация мутаций по адаптивному значению. По адаптивному значению мутации можно делить на полезные, нейтральные и вредные: летальные и полу летальные (семи-, или сублетальные). Это деление тоже очень условно и относительно.
Снижение жизнеспособности организмов и торможение развития вызывают мутации, которые относятся к группе полулетальных или летальных. Методы анализа их наследования будут рассмотрены ниже.
Мутации, увеличивающие жизнеспособность особей, расширяющие их адаптационные возможности, повышающие плодовитость, относят к числу полезных. Примером может служить мутация, приводящая к увеличению синтеза антибиотиков
в клетках грибов — продуцентов антибиотиков, ибо она увеличивает вероятность выживания таких клеток.
Между полезными, летальными и полулетальными мутациями существуют почти непрерывные переходы. Есть мутации, которые не изменяют вероятности выживания особи или оставления ею потомства, их, очевидно, можно отнести к числу нейтральных.
Классифицировать мутации по их адаптивному значению можно только условно, так как при изменении условий внешней среды мутации из полезных могут стать вредными или наоборот. У лабораторного объекта — дрозофилы мутанты с белыми глазами в нормальных условиях выращивания обладают пониженной жизнеспособностью по сравнению с мухами дикого типа. При повышении температуры белоглазые мухи оказываются более приспособленными и успешно конкурируют с красноглазыми. А. Густафсон описал ярко-зеленый хлоро-фильный мутант (полезная мутация) у ячменя, который давал значительно больший урожай на севере Швеции. На юге этот мутант нейтрален.
При оценке адаптивного значения мутаций надо иметь в виду также, что признаки, полезные с точки зрения хозяйственной, могут быть нейтральными или даже вредными биологически. Например, только что рассмотренная мутация синтеза антибиотиков хозяйственно тем полезнее, чем больше антибиотика синтезирует клетка —- продуцент. Для организма же она является полезной лишь до определенного предела, а потом чрезмерный синтез антибиотика начинает угнетать клетку и может привести ее к гибели. Те же рассуждения относятся и к мутациям, увеличивающим молочную продуктивность у крупного рогатого скота, тонину шерсти у овец, толщину сала у свиней и т. д. При чрезмерной гипертрофии одних признаков начинается дисгармоничное развитие других, часто приводящее к гибели всего организма.
Классификация мутаций по характеру изменений генотипа. Почти любое изменение в структуре, или числе хромосом, или в некоторых важнейших клеточных органоидах, при котором клетка сохраняет способность репродуцироваться, обусловливает наследственное изменение признаков организма. Приведем общепринятую классификацию мутаций по генотипу.
Генные, или точковые, мутации: цитологически невидимые изменения в хромосомах.
Хромосомные: внутрихромосомные и межхромосомные перестройки.
Геномные: изменение количества хромосом.
Цитоплазматические: изменения плазмогенов.
Организмы, у которых изменен генотип любым из только что упомянутых способов, называются мутантами.
198
199
 2. ГЕННЫЕ МУТАЦИИ
2. ГЕННЫЕ МУТАЦИИ
Характеристика генных мутаций. Мутации генов (точковые) встречаются у всех органических форм. Как уже было сказано, они происходят в отдельных клетках и проявляются скачкообразно у отдельных особей (мутантов).
Аллели генов, типичные для диких форм вида, называют генами дикого типа или нормальными, а измененные — мутант-ными. Принципиальной разницы между ними не существует. Многие гены, свойственные диким формам вида, также были когда-то мутантными, а затем благоприятные мутантные аллели в ходе эволюции вида распространились до такой концентрации, что каждая особь вида стала их носителем.
Большинство мутаций при возникновении оказываются рецессивными. Это очень важно для существования вида, так как в большинстве своем вновь возникающие мутации, нарушая целостную систему генотипа, оказываются вредными. Однако их рецессивный характер позволяет им длительное время сохраняться у особей вида в гетерозиготном состоянии без вреда для них и проявиться в будущем при переходе в гомозиготное состояние.
Мутации гена от дикого типа к новому состоянию называют прямыми, а от мутантного к дикому — обратными. Сам процесс обратного мутирования называют реверсией гена. Прямые мутации чаще являются рецессивными, а обратные — доминантными. Исходный ген мутирует в новое состояние и обратно без промежуточных ступеней. Частота возникновения прямых мутаций для разных генов бывает различной, в среднем на 100 тыс. или на 1 млн. генов мутирует от одного до пяти, т. е. мутации — явления очень редкие. Однако при учете суммарной частоты встречаемости различных мутантных генов в популяциях растений, животных и человека эта цифра резко увеличивается. Так, специальные расчеты показали, что каждая гамета у людей несет до 5—6 рецессивных мутантных генов, уменьшающих жизнеспособность (см. стр. 232). Одни и те же мутации могут появляться в разное время. Это говорит о том, что гены могут мутировать в одном направлении многократно.
В ряде случаев возврат к дикому типу представляет собой не обратную мутацию гена, а имитируется мутацией другого гена. Гены, которые путем взаимодействия с другими рецессивными генами приводят к появлению дикого фенотипа, называются супрессорами, а такой тип взаимодействия, являющийся частным случаем эпистаза,— супрессией. Поэтому, прежде чем решить вопрос, действительно ли произошла обратная мутация, необходимо провести генетический анализ. В исследованиях, проводимых на дрозофиле, бактериях и фагах, нейроспоре и дрожжах, было показано, что реверсия к дикому типу может
Происходить не только за счет обратных мутаций гена, но и за счет мутаций других генов — супрессоров.
Множественный аллелизм. До сих пор при изложении материала мы исходили из положения, что один и тот же локус гомологичных хромосом может быть представлен двумя аллелями: А и а, В и Ь, С и с и т. д. На самом деле один и тот же ген может изменяться в несколько состояний; иногда таких состояний бывает несколько десятков и даже сотен. Ген А может мутировать в состояние а1, а2, а? ... ап. Ряд состояний одного и того же гена называют серией множественных аллелей, а само явление — множественным аллелизмом. Схематически возникновение серии множественных аллелей иллюстрируется на рисунке 85.
Изучение серий множественных аллелей показало, что любая аллель такой серии может возникать мутационно непосред-
|
|
85. Д ^ *ig
Схема возникновения серии мно- j
жественных аллелей:
/ — две аллели одного гена; 2 — серия из четырех аллелей; стрелками указано направление мутирования.
ственно от аллели дикого типа или любого другого члена данной серии, а каждый из членов серии, по-видимому, имеет свою характерную частоту мутирования.
Наследование членов серии множественных аллелей подчиняется менделевским закономерностям. При этом, в отличие от генов, для которых известно только два состояния, сочетание двух разных членов серии множественных аллелей в гетерози-готе называют компаундом.
Рассмотрим примеры множественного аллелизма и наследование серии аллелей одного гена.
У норок существует серия множественных аллелей по окраске шерсти: коричневая (дикий тип), платиновая (серебристо-голубая) и белая. При скрещивании коричневых норок с платиновыми в Fi доминирует коричневая окраска. В F2 наблюдается расщепление в отношении 3 коричневые: 1 платиновая. Скрещивание платиновой с белой дает гибридов F\ с признаками первого родителя, а в F2 происходит расщепление: 3 платиновые к 1 белой. При скрещивании коричневой с белой также имеет место полное доминирование коричневой окраски в F[ и расщепление 3:1 в F2 (рис. 86). Обычно серию множественных аллелей обозначают по названию признака, впервые найденного, или по общему характеру действия данного ло-куса, способного мутировать в разные состояния. Серия окраски
200
201


VV"
87, шерсти у норок обозначается буквой
| Неполное доминирование в серии множественных аллелей. Аллели о\ vb, vf определяют рисунок седоватых пятен на листьях белого клевера. |
Р — РР — коричневая; рр — платиновая; phph — белая.
Изучение наследования признаков в случае множественного алле-лизма способствует углублению понимания явления доминирования и показывает его относительный характер: одна и та же аллель может быть доминантной или рецессивной по отношению к другим аллелям того же гена.
Нередко доминирование у гетерозигот серии бывает неполным. Так, у белого клевера ген, обусловливающий рисунок пятен на листе, представлен серией из 10 аллелей. В этом случае в компаунде имеет место неполное доминирование — проявление обеих аллелей, что хорошо видно на рисунке 87.
| jAjB |
Серии множественных аллелей обнаружены у крупного рогатого скота, кроликов, мышей, морских свинок, дрозофилы, а также у кукурузы, табака, гороха и др. У человека известна серия аллелей: /А, /в, 1°, которая определяет полиморфизм по группам крови:
| IAIA или 1А1° |
| jBjB jQjO |
| ВтО |
| 1а1 |
| или |
Группа АВ соответствует генотипу
» А » »
В О
Существование серии множественных аллелей локуса, определяющего самостерильность у растений, является тем механизмом, который в ряде случаев обеспечивает перекрестное оплодотворение. Так, было показано, что у табака, клевера и других растений на рыльцах прорастает только пыльца, несущая аллель, отличную от аллелей, имеющихся в генотипе рыльца по локусу самостерильности. Этот ген обозначают буквой S, а аллели нумеруют; у красного клевера, например, в этой серии описаны аллели от Si до S3o- Если диплоидное рыльце имеет генотип S\ и 52, то на нем прорастет пыльца всех аллелей, кроме S\ и 5г, т. е. не прорастет пыльца того же растения, чем и обеспечивается самонесовместимость и обязательное перекрестное опыление. Множество аллелей в таких сериях обеспечивает большую вероятность прорастания чужой пыльцы, т. е. осуществление перекрестного оплодотворения.
Распространенность множественного аллелизма среди животных, растений и микроорганизмов и наличие его у человека могла быть обусловлена тем, что это явление увеличивает резерв мутационной изменчивости, а потому имеет приспособительное значение в эволюции. В свете современных данных о строении гена складывается впечатление, что любой локус может быть представлен серией множественных аллелей с большим или меньшим числом членов (см. гл. 17).
ХРОМОСОМНЫЕ МУТАЦИИ
Внутрихромосомные изменения. Хромосомные перестройки принято относить к мутациям, так как их наличие в клетках обычно связано с изменениями свойств этих клеток или возникающих из них организмов.
К внутрихромосомным изменениям относят: нехватки части хромосомы (дефишенси и делеции); удвоение, или, точнее, умножение, тех или иных участков хромосомы {дупликации); изменение линейного расположения генов в хромосоме вследствие перевертывания на 180° отдельных участков хромосомы {инверсии).
Нехватки могут захватывать участки хромосом различной длины и в разных частях ее. Если разрыв происходит в одной из плеч хромосомы так, что один из ее концов утрачивается (рис. 88,7), то данное плечо укорачивается. Оторвавшийся фрагмент вместе с содержащимися в нем генами теряется при ближайшем делении ядра, если он лишен центромеры. Такие нехватки называют терминальными (или концевыми).
Разрывы иногда происходят одновременно в двух плечах хромосомы, вследствие чего элиминируются оба ее конца (рис. 88,2). При этом открытые концы могут соединиться, образуя в митозе кольцеобразную хромосому.
202
203

|
|
|
| А В CD Ј |
| ШУ-уЩШ) |
| Ю± |
| А В С d e |

88, Нехватки также образуются при
| Типы нехваток хромосом: / — концевая нехватка; 2 — концевые нехватки; 3 — виутрихро-мосомная нехватка. |
двух одновременных разрывах в одном плече хромосомы (рис. 88,3). Места разрывов соединяются, и хромосома становится короче, при этом внутренний участок элиминируется. Если выпавший фрагмент достаточно велик, то перед элиминацией открытые его концы могут соединиться, а в метафазе обнаруживается ацентрическое кольцо.
К малым нехваткам относят такие, которые связаны с выпадением нескольких хромомер или только части хромомеры — это микроделеции. Микроделеции можно обнаружить только при исследовании гигантских хромосом. Мелкие нехватки обычно сохраняются в гомозиготном состоянии, давая иногда фенотипический эффект и имитируя генную мутацию. Единственный показатель, по которому их отличают от мутации гена,— это отсутствие обратного мутирования.
Большие нехватки, как правило, в гомозиготном состоянии детальны, что подтверждает большое значение каждого локуса хромосомы для жизни клетки и организма. Жизнеспособными могут быть только гетерозиготы по нехваткам. В этом случае мутации, определяемые нехватками, проявляются как доминантные. Нехватки вызывают, как правило, понижение общей жизнеспособности и плодовитости особей. Фенотипический эффект нехватки участка хромосомы объясняют тем, что она нарушает
генетическую систему хромосомы, последовательность расположения генов, их взаимосвязь.
Крупную нехватку, затрагивающую несколько дисков, можно обнаружить генетическими и цитологическими методами. Так, например, существует линия дрозофилы, где самки в одной из Х-хромосом несут нехватку части хромосомы, содержащую ген white. Эта нехватка, названная в свое время мутацией Notch, в гетерозиготном состоянии обусловливает развитие вырезки на крыльях, т. е. является доминантной. В гомозиготном состоянии она обусловливает гибель организма, т. е. обладает рецессивным летальным действием.
Если скрестить самку дикого типа, имеющую нормальные половые хромосомы, с самцом, несущим в единственной Х-хро-мосоме три рециссивных гена в гемизиготном состоянии: у— желтый цвет тела, w — белые глаза и / — вильчатые щетинки, то все особи первого поколения будут по фенотипу нормальными:
При скрещивании же гетерозиготной самки из линии, несущей аллели у+ и /+ и в гетерозиготе нехватку локуса w, с самцом ywf в Fi половина самок будет дикого типа, а именно у w f + + + ; другая лоловина окажется с вырезками на крыльях
и белыми глазами: +___ + . Очевидно, у таких самок рецессив
ный ген w проявился вследствие того, что доминантная аллель
w+ в гомологичной хромосоме отсутствует, а вырезки на крыль
ях также являются следствием нехватки.
Как же осуществляется конъюгация гомологичных хромосом в мейозе в случае нехватки участка в одной из них? В мейоти-ческих хромосомах это наблюдать трудно. Лишь когда утрачивается достаточно большой участок хромосомы, такие нехватки можно обнаружить в пахитенной стадии.
Удобной моделью для изучения нехваток являются гигантские хромосомы. Гомологичные хромосомы слюнных желез дрозофилы в норме конъюгируют довольно тесно (соматическая конъюгация). При этом идентичные диски тесно прилегают друг к другу. Но в случае гетерозиготного состояния по нехватке внутреннего участка одной из хромосом нормальная конъюгация в этом районе нарушается. Диски такого участка нормальной хромосомы, не имея себе партнеров в другой хромосоме, образуют петлю, в то время как все остальные гомологичные диски в обеих хромосомах тесно прилегают друг к другу (рис. 89).
204
205

abed e f
|
| норма индерсия |
| A F |

| bed |
 Если в норме в каждой хромосоме ген представлен одной дозой, то при удвоении или умножении несущего его участка •— дупликации доза гена соответственно увеличится в 2 и более раз. Например, если гены в нормальной хромосоме расположены в порядке ABC, то при дупликациях одного из генов могут возникнуть состояния АВВС или АВВВС и т. д. По-видимому, более частым случаем дупликации является повторение идентичных участков хромосомы, содержащих несколько генов, например: АВСАВСАВС, что обнаружено у мыши, нейроспоры, аспергилла, кукурузы и др. Прекрасным примером накопления идентичных участков хромосомы является изменение фенотипи-
Если в норме в каждой хромосоме ген представлен одной дозой, то при удвоении или умножении несущего его участка •— дупликации доза гена соответственно увеличится в 2 и более раз. Например, если гены в нормальной хромосоме расположены в порядке ABC, то при дупликациях одного из генов могут возникнуть состояния АВВС или АВВВС и т. д. По-видимому, более частым случаем дупликации является повторение идентичных участков хромосомы, содержащих несколько генов, например: АВСАВСАВС, что обнаружено у мыши, нейроспоры, аспергилла, кукурузы и др. Прекрасным примером накопления идентичных участков хромосомы является изменение фенотипи-
| Ъг ; |
| ш/т |
| "■**A-».W/j |
|
|
vfffiW
89.
| Конъюгация гомологичных хромосом при наличии нехватки в одной из них. Участки гигантских хромосом (слева) и схема их (справа): / — нормальные хромосомы; 2 — в одной из хромосом имеется нехватка локусов BCD. |
ческого проявления формы глаз типа Ваг у дрозофилы (см. гл. 9).
Дуплицированные участки не только могут находиться в соседних участках хромосомы, как это наблюдается в случае возникновения эффекта Ваг, но могут быть распределены по всей хромосоме, а в некоторых случаях перемещены и в другие хромосомы. По-видимому, умножение идентичных участков является широко распространенным явлением в эволюции хромосом и видов.
Если в каком-либо участке нормальная последовательность генов ABCD, то при перевертывании на 180° — инверсии участка ВС этот порядок может измениться и стать ACBD.
Для образования инверсии внутри хромосомы необходим разрыв в двух точках. Инверсии часто связаны с рециссивным летальным эффектом, поэтому они не сохраняются в гомозиготном состоянии, и их обычно обнаруживают в гетерозиготе:
ABCDEF b а с d e f
Однако встречаются и такие инверсии, которые не связаны с летальным эффектом.
90.
| Дицентрическая хромосома d Ацентрическая хромосома a b С D e f |
Конъюгация и кро-ссинговер в случае гетерозиготной инверсии в акроцент-рнческой хромосоме и продукты мейоза:
/ — нормальная (аЬс def) и инвертированная (AEDCBF) хромосомы до конъюгации; 2 — конъюгация; 3 —
одинарный кроссин-
 говер н продукты
говер н продукты
мейоза (дицентриче-
ская и ацентрическая
хромосомы); 4—двой
ной кроссинговер и
продукты мейоза;
светлым кружком
обозначены центромеры.
Инверсию можно обнаружить цитологически в гигантских хромосомах или на пахитенной стадии мейоза. При гомозиготной инверсии конъюгация хромосом и кроссинговер осуществляются нормально. При гетерозиготной инверсии происходит конъюгация хромосом, как это показано на рисунке 90. Инвертированная хромосома образует петлю, а нормальная огибает ее. Перекрест хромосом у таких гетерозиготных по инверсиям особей происходит также своеобразно.
На рисунке 90, 3 можно видеть, что если происходит одинарный обмен между хромосомами, то в результате образуются две необычные хромосомы: одна из них без центромеры, элиминирующаяся при делении клетки, а другая — с двумя центромерами (дицентрическая хромосома). Последняя в анафазе I при полярном расхождении центромер образует хромосомный «мост». Мост может разорваться в любом месте, в результате чего гаметы получат хромосомы с более или менее значительными
20G
207
нехватками по одним участкам и с дупликациями по другим и поэтому окажутся нежизнеспособными. Нормальные жизнеспособные гаметы могут образовываться только за счет хромосом, не вступивших в перекрест или претерпевших двойной кроссин-говер (рис. 90,4). Однако последний случай встречается очень редко. Так как кроссоверные гаметы за счет одинарного крос-синговера оказываются нежизнеспособными, то и создается впечатление об отсутствии или подавлении кроссинговера у гетеро-зигот по инверсиям. Поэтому инверсии иногда называются за-пирателями кроссинговера.
Инверсии встречаются в природных популяциях животных и растений, а также могут быть получены в эксперименте, особенно под влиянием ионизирующих излучений и ряда химических веществ. Полагают, что инверсии имеют существенное значение в образовании видов, приводя к внутривидовой изоляции.
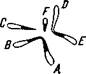
Межхромосомные изменения. Кроме рассмотренных внутри-хромосомных перестроек существуют изменения, связанные с обменом участками между негомологичными хромосомами. Такие межхромосомные перестройки называются транслокациями.
Допустим, что в норме одна пара хромосом несет гены
ABCD EFGH „
——---- , а другая пара — гены ———. При одновременном раз-
ABCD EFGH
рыве в двух негомологичных хромосомах оторвавшиеся сег-
л ABGH EFCD
менты взаимно обменяются местами, например:------ и --------- ,
к ^ ABCD EFGH
при этом обменявшиеся участки могут быть равной или неравной длины и, таким образом, включать равное или неравное количество генов. Такой тип обмена называют взаимной или ре-ципрокной транслокацией.
Главным генетическим эффектом транслокации является изменение групп сцепления: перемещенные гены входят в новые группы сцепления, и тем самым нарушается сложившаяся система генотипа.
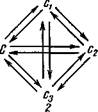
Большой интерес представляет поведение транслоцированных хромосом в мейозе, так как конъюгация таких хромосом у гетерозиготных особей протекает своеобразно. У гетерозиготы по транслокации в профазе I при конъюгации образуется фигура в виде креста. Она возникает в силу того, что гомологичные локусы, оказавшиеся в разных хромосомах, испытывают взаимное притяжение на стадии зигонемы (рис. 91). В стадии дипло-немы крестообразные фигуры образуют сложные хиазмы. В диа-кинезе в силу сползания хиазм от центромер к концам хромосом образуются кольцеобразные фигуры. Иногда хромосомы кольца, переворачиваясь, образуют фигуры в виде восьмерки. Именно такой тип расположения хромосом и дает жизнеспособные сбалансированные гаметы (рис. 91, /), так как в этом слу-
| Сперматозоид __ с транслокаиией |
| а и . и и |
 чае к одному полюсу отходят либо обе измененные хромосомы, либо обе неизмененные. Когда же хромосомы расположены в мейозе в виде колец, образуются гаметы с несбалансированными геномами: в одних — гены повторяются дважды, в других — они отсутствуют, т. е. имеется либо удвоение, либо нехватка (рис. 91, 2, 3). Нежизнеспособные гаметы в некоторых случаях можно определить под микроскопом, например, стерильные микроспоры у кукурузы, энотеры и др. оказываются сморщенными или пустыми в отличие от нормальных.
чае к одному полюсу отходят либо обе измененные хромосомы, либо обе неизмененные. Когда же хромосомы расположены в мейозе в виде колец, образуются гаметы с несбалансированными геномами: в одних — гены повторяются дважды, в других — они отсутствуют, т. е. имеется либо удвоение, либо нехватка (рис. 91, 2, 3). Нежизнеспособные гаметы в некоторых случаях можно определить под микроскопом, например, стерильные микроспоры у кукурузы, энотеры и др. оказываются сморщенными или пустыми в отличие от нормальных.
| АППС AABD ЛССВ |
| Сбалансированные гаметы |
| Несбалансированные гаметы |
| 91 |
| Картины конъюгации и продукты мейоза при гетерозиготных траислокациях: / — образование сбалансированных гамет в случае расположения хромосом в виде восьмерок в мейозе; 2, 3 — образование несбалансированных гамет в случае кольцеобразного расположения хромосом в мейозе. |
У кукурузы ориентация хромосом в виде восьмерок происходит примерно в 50% случаев, что приводит к образованию 50% фертиль-ных гамет. У дурмана, пшеницы, ячменя, томатов, энотеры и других растений ориентация в виде восьмерок происходит более часто, что и объясняет большую их фертильность.
У ряда высших растений, например у энотеры, пиона, дурмана, колокольчика и др., наличие гетерозиготных транслокаций в генотипе является нормальным состоянием. Транслокации распространены и среди животных, особенно часто они встречаются у кузнечиков и скорпионов.
Механизмы возникновения хромосомных перестроек и их значение. Механизм возникновения хромосомных перестроек остается еще далеко не ясным. Частота хромосомных перестроек зависит от внешних агентов (ионизирующих излучений, химических веществ) и физиологического состояния организма.
208
° Генсека с основами селекции
209


|
|
| гл . |
Деления
| KSliWl |
о
о >
| \ |
 Аиентрическае кольио
Аиентрическае кольио
92.
Механизмы возникновения вну-трихромосомных перестроек при разрывах в акроцентрической хромосоме. Цифрами обозначены гены.
Инверсия
Образование всякой хромосомной перестройки происходит благодаря разрыву и соединению фрагментов.
Рассмотрим, как возникают делеции и инверсии в одноплечих (акроцентрических) хромосомах.
Если акроцентрическая хромосома, гены которой на рисунке 92 обозначены цифрами, случайно образовала петлю и в точке контакта произошел разрыв, то соединение может идти тремя путями: с сохранением нормальной структуры хромосомы, с образованием хромосомы с делецией и ацентрического кольца, которое в метафазе окажется неориентированным в силу отсутствия центромеры, и элиминируется с возникновением инверсии.
Таким же образом и в метацентрической хромосоме может либо восстанавливаться нормальная структура, либо возникать хромосомная аберрация.
Разрыв и обмен могут осуществляться в момент, когда хромосома представлена функционально единичной нитью (ранняя интерфаза) или двумя хроматидами (поздняя интерфаза и профаза I). Перестройки, происшедшие на стадии единичной нити, называются иногда хромосомными перестройками, а на стадии двух хроматиД — хроматидными перестройками.
Изучение хромосомных перестроек дало генетикам метод исследования генотипа как системы. Хотя хромосомы наследст венно дискретны, т. е. различные их локусы определяют развитие разных признаков и свойств организма, но все же каждая хромосома представляет целостную систему взаимодействующих
210
генов, сложившуюся в процессе эволюции. Доказательством этого служат факты, показывающие, что изменение порядка генов в инверсиях и транслокациях часто является причиной возникновения, новых признаков. Это же явление наблюдается при некоторых дупликациях и нехватках.
А. Стертевант, обнаружив мутацию Ваг, истолковал ее как следствие изменения положения гена в хромосоме, вызвавшее изменение признака. Изменение действия гена в зависимости от его положения в системе других генов он предложил называть эффектом положения. Это была первая попытка рассматривать ген не как самостоятельную единицу, а как часть всей системы генотипа. Теперь получено много фактов в пользу правоты такой точки зрения (см. гл. 24).
Разлом хромосомы, происшедший вблизи какого-либо гена, вызывает изменение характера его доминирования. Один из убедительных примеров такого рода был получен Б. Н. Сидоровым и Н. П. Дубининым. Ими наблюдалось изменение доминирования гена ci (прерванная жилка крыла), находящегося в IV хромосоме дрозофилы. Если в IV хромосоме происходит разрыв в непосредственной близости от нормальной доминантной аллели гена ci+ и к этому месту прикрепляется фрагмент другой хромосомы, то свойство доминирования нормальной аллели ослабляется и рецессивный ген ci, находящийся в гетерозиготном состоянии, проявляется.
Б. Н. Сидоровым был установлен другой очень важный факт, а именно обратимость эффекта положения. Рецессивный ген h (добавочные щетинки) проявляется в гетерозиготном состоянии при изменении его местоположения в результате транслокации в III хромосому. При возвращении его обратно в IV хромосому характер проявления гена восстанавливается к исходному типу. Таким образом установлено, что изменение проявления гена может зависеть от новой внутрихромосомной «среды» без изменения структуры самого гена.
В настоящее время считается общепринятым, что любые хромосомные перестройки или вызывают видимый эффект, или затрагивают жизнеспособность, плодовитость и другие физиологические свойства организма. Эти явления лучше всего объяс-няются с точки зрения эффекта положения гена. Удовлетворительного объяснения механизмов явления эффекта положения пока не дано. Его изучение является проблемой будущего, решение которой может преодолеть формализм в толковании целого ряда генетических явлений, так как эффект положения позволяет рассматривать ген как функциональную генетическую единицу, а генотип как целостную систему, характерную для каждого вида.
С помощью хромосомных перестроек могут создаваться новые системы генотипов. Так, в случаях ' возникновения
| 8* |
211

|
|
|
93. жизнеспособной формы, гомозиготной
Гаплоидные наборы хромо- п0 транслокации, инверсии или дупли-
сом некоторых видов рода кации, она может оказаться приспо-
Drosophila: собленной к определенным условиям
гш'5' з™Dn°^iSiHSrioni~ 4-d" существования и размножится, а за-
americana. Закрашены' гомоло- Тем обоСОбИТСЯ В НОВЫЙ ВИД. У ЭТОГО
гичные участки хромосом. mBQm ввда сохраняются преЖНИе Ге-
ны, но либо они окажутся в других группах сцепления, либо изменится последовательность расположения их в хромосоме (рис. 93). Следовательно, роль хромосомных перестроек важна и для эволюции.
ГЕНОМНЫЕ МУТАЦИИ
Сущность и причины возникновения геномных мутаций.
Число, форма и размер хромосом являются систематическими признаками для каждого вида. Основной единицей кариотипа является гаплоидный набор хромосом, т. е. такой набор, в котором из каждой пары гомологичных хромосом представлена только одна. Совокупность генов, заключенную в таком гаплоидном наборе, называют геномом, а число хромосом в гаплоидном наборе — основным числом и обозначают буквой п.
Митоз и мейоз являются точнейшими механизмами деления клетки, обеспечивающими постоянство числа хромосом из поколения в поколение. Однако в некоторых случаях эти механизмы нарушаются, что может выражаться в неравном расхождении хромосом к полюсам клетки — нерасхождение хромосом (см. гл. 8), а также в удвоении хромосом, но без цитокинеза (эндоми-тоз). В результате таких нарушений возникают клетки с измененным числом хромосом.
Причины нарушения нормального деления клеток, приводящие к нерасхождению хромосом и торможению цитокинеза, до конца не выяснены. Предполагают, что в первую очередь здесь играет роль изменение в ахроматиновом аппарате клетки: повреждение сократительной функции тянущих нитей веретена, а также центромер и центриолей, потеря полярности делящейся клетки, значительное увеличение вязкости цитоплазмы. Возможны и другие причины, связанные с изменением общего физиологического состояния клетки.
212
Изменение числа хромосом может происходить за счет увеличения или уменьшения числа целых гаплоидных наборов или отдельных хромосом. Организмы, у которых произошло умножение целых гаплоидных наборов, называют полиплоидами. Организмы, у которых число хромосом не является кратным гаплоидному, называют анеуплоидами или гетероплоидами.
Изменения числа хромосом в клетках организма сопровождаются изменением его признаков и свойств, а потому называются геномными мутациями.
Полиплоидия. Полиплоидия — это геномная мутация, состоящая в увеличении числа хромосом, кратном гаплоидному. Клетки с разным числом гаплоидных наборов хромосом называются: Зп — триплоидные, An — тетраплоидные, Ъп — пентаплоидные и т. д. Организмы, развившиеся из полиплоидных клеток, будут называться соответственно триплоидами, тетраплоидами, пен- таплоидами и т. д.
Если диплоидная соматическая клетка содержала три пары хромосом: 2п = ЗХ2 = 6 (I, I; II, II; III, III), то после удвоения она будет содержать двойной комплекс хромосом: 4я = ЗХ4=12 (I, I, I, I; II, II, II, II; III, III, III, III). В этом случае происходит умножение числа каждой из хромосом. Тетраплоид, возникший из гомозиготного организма, также будет гомозиготным. Если же умножение наборов происходит у гибридного организма, который в гомологичных хромосомах несет разные аллели одних и тех же генов, тогда и образовавшийся тетраплоид будет гетерозиготным по этим генам.
В случае полиплоидизации соматических клеток клетки будут полиплоидными только в той части организма, которая разовьется из исходной полиплоидной клетки, и организм окажется химерным. Если полиплоидизация происходит при первом делении зиготы, то все клетки зародыша оказываются полиплоидными. Отсутствие расхождения всех хромосом в мейозе приводит к образованию гамет с нередуцированным числом хромосом, такие гаметы будут иметь не по одному набору хромосом, а по два. При участии в оплодотворении гамет с нередуцированным набором хромосом могут появиться полиплоидные организмы.
Полиплоидия приводит к изменению признаков организма, а потому является важным источником изменчивости в эволюции и селекции, особенно у растений. На фотографии растений диплоидной и тетраплоидной ржи селекции В. С. Федорова это хорошо видно (рис. 94). Тетраплоидная форма имеет более мощную соломину, колос и более крупное зерно, что делает ее хозяйственно более выгодной.
Первые экспериментально полученные полиплоиды томатов и паслена были описаны Г. Винклером еще в 1916 г. В настоящее время известно, что более Уз всех видов покрытосеменных растений являются полиплоидами. Достаточно обратиться
213




 к анализу числа хромосом различных видов пшениц, чтобы стала очевидной роль полиплоидии в их происхождении.
к анализу числа хромосом различных видов пшениц, чтобы стала очевидной роль полиплоидии в их происхождении.
Род пшеница (Triticum) состоит из нескольких видов, которые разделяются на три группы как по числу хромосом, так и по свойствам и признакам растений. К первой группе относятся, например, однозернянки (Т. monococcum), имеющие в соматических клетках диплоидное число хромосом, равное 14. Ко второй группе относится твердая пшеница (Т. durum), имеющая 28 хромосом. В третью группу входит мягкая пшеница (Т. aesti-vum), которая имеет 42 хромосомы. Если основное число хромосом у пшениц я = 7, то однозернянки оказываются диплои-дами (7X2=14), твердые пшеницы — тетраплоидами (7X4 = = 28), а мягкие — гексаплоидами (7x6 = 42). Такой же ряд полиплоидов известен внутри рода овса (Avena) и многих других растений.
Группа родственных видов, у которых наборы хромосом составляют ряд с возрастающим числом хромосом, кратным основному, называется полиплоидным рядом. Полиплоидный ряд может быть двучленным и многочленным.
Автополиплоидия. Полиплоиды, возникающие на основе умножения геномов одного вида, называют автополиплоидами. Если обозначить основное число хромосом (геном) буквой А, то А будет соответствовать гаплоиду, АА — автоди-плоиду, AAA — автотриплоиду, АААА — автотетраплоиду и т. д.
Автополиплоиды в естественных условиях возникают у организмов с любым способом размножения. Особенно ценны автополиплоиды у форм, размножающихся апомиктически и вегетативным путем, так как они могут сохраняться и размножаться в относительно неизменном виде длительное время. При половом размножении автополиплоиды дают наследственно разнообразные формы, если исходная форма была гетерозиготной.
Мейоз у автополиплоидов отличается от мейоза диплоидов. Так, например, у тетраплоида в профазе образуются не только биваленты, но и триваленты, и квадриваленты (поскольку могут конъюгировать между собой все гомологичные хромосомы), и униваленты. При более высокой плоидности возможность конъюгации всех гомологичных хромосом приводит к образованию поливалентов, или мультивалентов.
Известно, что если одна из пар хромосом диплоидного организма гетерозиготна по какому-либо гену (Аа), то в результате мейоза образуются два сорта гамет 1А : 1 а. В редукционном делении автотетраплоида ААаа, возникшего из гетерозиготного диплоида, расхождение гомологичных хромосом к полюсам возможно в следующих отношениях: 2:2, 3:1, 1:3, 4:0, 0:4. Гаметы с тремя, одной и без хромосом данной пары, а именно ААа и а, Ааа и Л, а также О, являются неполноценными. Это
215

 приводит к образованию нежизнеспособных зигот, т. е. снижает фертильность полиплоидов.
приводит к образованию нежизнеспособных зигот, т. е. снижает фертильность полиплоидов.
Но если даже у гетерозиготного автотетраплоида ААаа расхождение хромосом к полюсам будет проходить регулярно 2 :2, расщепление у тетраплоидов все же будет отличным от моногибридного расщепления у диплоида. Автотетраплоид, гетерозиготный по данной аллели ААаа, образует три типа гамет в отношении \АА :4Аа: \аа\ в F2 расщепление по фенотипу окажется 35: 1, т. е. будет значительно отличаться от такового у диплоида (3:1) (табл. 10). Расщепление 35:1 неоднократно подтверждалось в опытах с автотетраплоидными растениями, в частности впервые оно было получено в опытах с дурманом (Datura) при изучении наследования пурпурной и белой окрасок цветка. Существенно, что из 36 гибридов F2 34 являются гетерозиготами, в то время как у диплоидов гетерозигот лишь '/г- У гексаплоида в F2 расщепление будет 399 : 1.
Таблица 10
Моногибридное расщепление в F-2 у автотетраплоида
| ^\ с? 9 \^ | 1АА | 4 Аа | 1 аа |
| 1 АА 4 Аа 1 аа | 1 АААА 4 АААа 1 ААаа | 4 АААа 16 ААаа 4 Аааа | 1 ААаа 4 Аааа 1 аааа |
При моногибридном расщеплении вероятность появления гомозиготных рецессивных форм у автотетраплоида и автогекса-плоида во много раз меньше, чем у диплоида, по однозначно действующим генам при полимерии гомозиготные формы получить еще более трудно. Из этого следует, что полиплоидия поддерживает гетерозиготность в большей мере, чем диплоидия.
Изучение генетики автополиплоидов представляет особый интерес, так как у них соотношение рецессивных и доминантных аллелей сохраняется таким же, как у исходных диплоидов, а признаки изменяются. Это позволяет изучать влияние плоид-ности на проявление признаков.
На первых порах изучения полиплоидии сложилось представление, что полиплоидия у растений обязательно сопровождается увеличением размеров растений и его отдельных органов. Однако гигантизм проявляется далеко не у всех полиплоидов, хотя диплоиды по сравнению с гаплоидами всегда несколько крупнее. Полиплоиды, возникшие из гибридных растений, полученных от скрещивания разных линий, чаще проявляют гиган-
216
тизм, чем полиплоиды внутри одной линии. Это указывает на то, что гигантизм зависит не только от плоидности, но и от генотипа полиплоидного организма.
Наиболее общим свойством полиплоидов является увеличение размеров клеток. С увеличением объема клеток часто связано изменение ряда их физиологических и биохимических свойств: увеличение количества воды, уменьшение осмотического давления, изменение содержания различных веществ — белков, хлорофилла, клетчатки, ауксина, ряда витаминов и др. Последнее может вызвать вторичные явления, например изменить устойчивость полиплоидов к колебаниям внешних факторов, заболеваниям и т. д. Более высокие адаптационные свойства полиплоидов, несомненно, определяются также их наследственной обогащенностыо — более высокой гетерозиготностью.
Интересно отметить, что «живые ископаемые» растения — представители древних растительных групп — оказываются часто полиплоидными по отношению к их родственникам значительно менее древнего происхождения.
Аллополиплоидия. Полиплоиды, возникающие на основе умножения геномов разных видов, называются аллополи-плоидами или амфшглоидами. Аллополиплоиды образуются на основе скрещиваний различных видов. Так, например, если у межвидового гибрида совмещаются геномы Л и В, то полученный от него аллотетраплоид (амфидиплоид) будет ААВВ. Алло-полиплоидию иначе называют гибридной полиплоидией. Она имеет большое практическое значение.
Часто отдаленные гибриды оказываются бесплодными (например, гибриды ржи с пшеницей, редьки с капустой и др.). Рассмотрим одну из причин этого явления. Допустим, совмещаются геномы редьки R и капусты В, тогда редечно-капустный гибрид будет нести два разных генома — R и В. Редька привносит в зиготу гибрида геном R, состоящий из 9 хромосом, капуста— геном В, также представленный 9 хромосомами. Такой отдаленный гибрид в Fi имеет в соматических клетках общее число хромосом 18. В процессе образования половых клеток в профазе мейоза должна происходить конъюгация гомологичных хромосом. Но так как хромосомы редьки не имеют гомологов среди хромосом капусты, то у этого гибрида каждая из них ведет себя в мейозе самостоятельно, как унивалент. В клетках указанного гибрида в мейозе можно насчитать 18 уни-валентов. В анафазе I они будут беспорядочно распределяться к полюсам, и в силу этого образуются гаметы с различным числом хромосом — от 0 до 18, большинство их оказываются несбалансированными, т. е. число хромосом в них не кратно основному, а потому и нежизнеспособными.
Однако у такого гибрида некоторая часть как женских, так и мужских гамет будет нести 18 хромосом: 9/?+ 96. Эти гаметы
217

 называются нередуцированными. При объединении в процессе оплодотворения нередуцированных гамет образуется зигота с удвоенным набором хромосом обоих видов — аллотетраплоид, или ам-фидиплоид. Он имеет два набора хромосом редьки (9R + 9R) и два набора капусты (9В + 9В), т. е. всего 36 и оказывается фертильным, так как в мейозе у него каждая хромосома имеет партнера, с которым и конъюгирует.
называются нередуцированными. При объединении в процессе оплодотворения нередуцированных гамет образуется зигота с удвоенным набором хромосом обоих видов — аллотетраплоид, или ам-фидиплоид. Он имеет два набора хромосом редьки (9R + 9R) и два набора капусты (9В + 9В), т. е. всего 36 и оказывается фертильным, так как в мейозе у него каждая хромосома имеет партнера, с которым и конъюгирует.
| 18R+18B |
| 18В |
| Плоды и хромосомные наборы редьки, капусты и их гибридов: / — редька; 2 — капуста; 3 — диплоидный гибрид; 4 — ам-фидиплоид; R — редечные и В — капустные хромосомы. |
Получение амфидиплоидов открыло возможности синтеза новых константных форм путем гибридизации и удвоения у гибридов числа хромосом, так как для них характерно константнопромежуточ-ное наследование признаков без выщеп-ления исходных форм. Г. Д. Карпеченко в начале 20-х годов впервые получил межродовой плодовитый гибрид от скрещивания редьки (Raphanus sativus) с капустой (Brassica oleracea).
Такой гибрид был очень мощным и совмещал признаки редьки и капусты. Плодовитым и константным он оставался и в последующих поколениях. Эта новая форма, синтезированная на основе сочетания геномов двух родов, была названа рафанобрассикой (Raphanobrassica) или редечно-капу-стным гибридом.
На рисунке 95 представлены плод и хромосомный набор ра-фанобрассики (4). У этой формы стручок оказывается комбинированным: верхняя часть от редьки (рис. 95, /), а основание стручка типа капусты (рис. 95, 2). Диплоидная форма этого гибрида бесплодна (рис. 95, 3).
Аллополиплоиды, не существовавшие в природе, были получены также при скрещивании двух видов табака: Nicotiana tabacum (2 п = 48) и N. glutinosa (2n = 24) — М. Ф. Терновским. А. Р. Жебрак при скрещивании двух видов пшениц Triticum aestivum (2и = 42) с Т. timopheevi (2/г=28) и Т. durum (2/г = = 28) с Т. aestivum (2« = 42) получил 70-хромосомные пшеницы, которые тоже не существуют в природе.
Из рассмотренных примеров видно, что путем сочетания разных геномов и полиплоидизации можно синтезировать новые формы, которые не существуют в природе. Создание таких новых форм называют синтезом видов. После отбора в ряду поколений они становятся вполне константными и могут считаться само-
етбятельньшй таксономическими единицами. Установлено, что пшеницы, новосветский длинноволокнистый хлопчатник, некоторые ягодные и плодовые культуры и ряд других сельскохозяйственных растений произошли именно таким путем.
| Prunus dimricata |
| Prunus spinosa |
|
|
Наряду с созданием новых форм в генетике осуществлен ресинтез видов, т. е. искусственное восстановление уже существующих видов на основе отдаленной гибридизации. Так, в опытах В. А. Рыбина ресинтезирована культурная слива (Prunus dome-stica). Рыбин скрестил терн P. spinosa (2 я = 32) с алычой Р. divaricata (2«=16). Среди гибридов оказалось одно растение, которое имело, как и P. domestica, 2«=48 хромосом (рис. 96) и было очень сходно с домашней сливой. Это была константная и плодовитая форма.
Конечно, ресинтезированные виды не будут точной копией естественных видов, так как последние прошли длительную эволюцию в течение нескольких сотен и тысяч поколений. Но идя этим путем, генетик может не только изучить происхождение видов, но и получить возможность синтезировать новые виды, полезные человеку.
| Р domestica |
| 96. Схема ресинтеза домашней сливы (Prunus domestica) |
Из сказанного о полиплоидах следует, что плодовитость последних определяется характером конъюгации гомологичных хромосом в мейозе. Однако хромосомы находятся в тесной и сложной связи с цитоплазмой. Клетки функционируют как единая система, и поэтому различия в плодовитости полиплоидов могут определяться иногда совместимостью или несовместимостью геномов с цитоплазмой.
Роль цитоплазмы в гаметогенезе у аллополиплоидов можно показать на примере рафанобрассики, у которой равное количество редечных и капустных хромосом (18 R и 18 В). Цитоплазма этой формы принадлежитредьке, так как гибрид получен от опыления пыльцой капусты цветка редьки. Для выяснения роли цитоплазмы Г. Д. Карпеченко произвел обратные скрещивания с обеими родительскими формами. У гибридов Fa была одна и та же «редечная» цитоплазма, соотношение же хромосом менялось. В первом скрещивании аллотриплоид рафанобрасси-каХ редька имел в мейозе 9 бивалентов из редечных хромосом и 9 унивалентов хромосом капусты (9R + 9R + 9B). Во втором скрещивании рафанобрассика X капуста было обратное соотношение хромосом (9B + 9B + 9R), но и в том и в другом случае
218
219


 образовывалось 9 бивалентов и 9 унивалентов. Следовательно, можно было ожидать, что оба триплоида должны иметь одинаковый ход мейоза и одинаковую плодовитость. Оказалось, что действительно мейоз внешне протекает сходно у гибридов обоих типов, но во втором случае гаметы полностью гибнут, а в первом— нет (рис. 97). Причина этого в том, что в первом случае для 9 редечных бивалентов редечная цитоплазма своя, а во втором — для 9 капустных бивалентов она чужая.
образовывалось 9 бивалентов и 9 унивалентов. Следовательно, можно было ожидать, что оба триплоида должны иметь одинаковый ход мейоза и одинаковую плодовитость. Оказалось, что действительно мейоз внешне протекает сходно у гибридов обоих типов, но во втором случае гаметы полностью гибнут, а в первом— нет (рис. 97). Причина этого в том, что в первом случае для 9 редечных бивалентов редечная цитоплазма своя, а во втором — для 9 капустных бивалентов она чужая.

| 97. Схема, иллюстрирующая влияние совместимости цитоплазмы (Raphanus) и геномов (Raphanus и Bras-sica) на фертильность алло-триплоида Raphanobrassica: / — частично плодовитый гибрид; 2 — стерильный гибрид; Я — редечные геномы н цитоплазма (белый цвет), В — капустные геномы (черный цвет). Гаметы с несоответствующим плазме набором хромосом гибнут (зачеркнуты) . |
Таким образом аллополиплоиды с одинаковой цитоплазмой, но с различными наборами хромосом отличаются по плодовитости, так как цитоплазма в гаметогенезе у аллополи-плоидов играет существенную роль. Проблема совместимости и несовместимости геномов и цитоплазмы остается еще не решенной, хотя и очень важной для понимания взаимосвязи ядра и цитоплазмы, а также роли ал-лополиплоидии в эволюции растений и животных. Полиплоиды возникают спонтанно в природе. Для искусственного получения полиплоидов используют изменение температуры, ионизирующие излучения, механические воздействия (декапитация, пасынкование и др.), химические вещества —• колхицин, аценафтен и др.
Наиболее широко для получения полиплоидов используется алкалоид колхицин, добываемый из растения безвременник (Colchicum caucasicum). Для получения полиплоидов с помощью колхицина так же, как и других химических агентов, применяются различные методики, в зависимости от вида растения и фазы его развития.
Влияние колхицина на митоз настолько специфично, что в литературе утвердился специальный термин — К-митоз. Кол-
220
хицйн вызывает эндоМитоз, Парализуя механизм расхождения хромосом к полюсам, но не препятствуя их репродукции; генных мутаций и хромосомных перестроек при этом, как правило, не возникает.
Как видно из предыдущего, полиплоидия широко представлена у растений. Это связано с тем, что у них весьма широко распространены гермафродитизм (самоопыление), апомиксис (партеногенез) и вегетативное размножение. Очевидно существуют и другие причины, способствующие полиплоидии у растений.
Полиплоидия у животных. Установлено, что у раздельнополых животных полиплоидия встречается крайне редко. Особенно большие препятствия для сохранения полиплоидных клеток и их воспроизведения в поколениях возникают у таких раздельнополых организмов, которые имеют гетерогаметный и гомогаметный пол. У тех животных, у которых половое размножение заменено партеногенезом, полиплоидия может осуществляться почти так же, как у растений.
Примером полиплоидных рядов у животных могут являться таковые у аскариды, земляных червей, амфибий, бабочек и некоторых других. Установлено, что в семействе земляных червей (Lumbricidae) имеются полиплоидные ряды с разными основными числами: 11, 16, 17, 18 и 19 хромосом, в некоторых из рядов найдены даже декаплоиды. Полиплоидные земляные черви оказываются более крупными, чем ближайшие родственные им диплоидные виды. Более известны у животных двучленные полиплоидные ряды, т. е. диплоиды (2 п) и тетраплоиды (4 п) или 2 п и 3 п. Такие ряды обнаружены у некоторых насекомых, амфибий, ящериц.
В настоящее время получены автополиплоидные особи у тутового шелкопряда, тритона, аксолотля, зиготы — даже у млекопитающих (мышь, кролик). У автотетраплоидов шелковичного червя (Bombyx mori) самки плодовиты, а самцы стерильны. Причиной этого является то, что у самцов (гомогаметный пол) в профазе мейоза образуются поливаленты, в силу чего возникают нежизнеспособные гаметы с анеуплоидным числом хромосом. У самок (гетерогаметный пол) конъюгация хромосом ограничена, поливаленты не образуются, а формирующиеся гаметы жизнеспособны.
Одна из причин редкой встречаемости полиплоидов у раздельнополых животных — их бесплодие.
У млекопитающих обнаружены триплоидные зиготы. Однако триплоидные эмбрионы у мышей доживают только до середины эмбрионального развития. Случаи триплоидии и тетраплоидии обнаружены при анализе материала спонтанных абортов у человека.
Искусственное получение аллополиплоидов у животных до недавнего времени считалось неразрешимой проблемой. Однако
221
совсем недавно Б. Л. Астаурову с сотрудниками удалось создать первый аллополиплоид от межвидового гибрида шелкопрядов Bombyx morixB. mandarina. При синтезировании аллотетрапло-ида использовался метод искусственного партеногенеза. Вначале были получены партеногенетические автополиплоиды В. mori — 2ft, 3n, An. Все эти особи оказались женского пола и были плодовиты. Затем произвели скрещивание тетраплоидных самок В. mori (An) с диплоидными самцами другого вида — В. mandarina (2/г). У обоих этих видов /г = 28 хромосомам. В потомстве от такого скрещивания появлялись аллотриплоидные самки 2 п В. mori+1/г В. mandarina. Эти самки, стерильные в обычных условиях, размножались путем партеногенеза. При этом иногда возникали аллогексаплоидные самки An В. mori + 2ft В. mandarina. В потомстве от скрещивания этих самок с диплоидными самцами В. mandarina (2ft) были отобраны формы обоего пола с удвоенным набором хромосом каждого вида 2ft В. mori + 2/г В. mandarina — аллотетраплоиды, или амфидипло-иды. К настоящему времени воспроизведено уже шесть поколений таких аллотетраплоидов.
В мире животных полиплоидия довольно широко распространена в соматических клетках ряда тканей, т. е. в тех случаях, когда клетки размножаются митотическим путем без мейоза.
В настоящее время большинство генетиков придерживается той точки зрения, что в эволюции животных основную роль играла не полиплоидия, а межхромосомные и внутрихромосомные перестройки. Однако пути эволюции организмов разнообразны, и выработанные ею механизмы приурочены к конкретной эволюции каждого класса, отряда, рода и вида.
Анеуплоидия. Анеуплоидия (или гетероплоидия) —это геномная мутация, состоящая в изменении числа хромосом, некратном гаплоидному.
Впервые это явление было обнаружено К. Бриджесом чисто генетическими методами при изучении у дрозофилы наследования признаков, сцепленных с полом. В главе 8 приводились примеры наследования признаков при нерасхождении половых хромосом у самки дрозофилы. Эти генетические опыты были затем подтверждены цитологически. Действительно, в соматических клетках самок ХХУ была обнаружена лишняя У-хромо-сома, у самцов ХО недоставало У-хромосомы.
Возникновение клеток с измененным числом отдельных хромосом объясняется тем, что при делении клетки происходят нарушения в расхождении некоторых пар хромосом. Эти нарушения возможны в соматических и в половых клетках. Но наиболее вероятно нерасхождение гомологичных хромосом в мейозе, когда происходит конъюгация хромосом и образование бивалентов. Бивалент целиком может отойти в одну клетку, и тогда в другой клетке эта пара гомологичных хромосом отсутствует.
222
Постоянно анеуплоидные гаметы появляются у таких форм с нарушенной конъюгацией гомологичных хромосом, как некоторые полиплоиды и отдаленные гибриды, о чем уже шла речь.
Если гамета, имеющая дополнительную хромосому (я+1), сочетается с нормальной, гаплоидной (/г), то зигота оказывается с одной лишней хромосомой; число хромосом у нее будет равно 2я+1. При сочетании гаметы, утратившей одну хромосому, с нормальной, т. е. гаплоидной, гаметой образуется зигота с неполным диплоидным числом, с нехваткой одной хромосомы 2п—1.
Организм с набором хромосом 2ft+1 называется трисомиком, 2/г — 1 — моносомиком, а 2/г — 2 — нулисомиком. В некоторых редких случаях одна и та же пара хромосом может иметь дополнительно не одну хромосому, а две (2/г+ 2)—тетрасомик, три (2/г + З) — пентасомик и т. д.
Уменьшение или увеличение числа может наблюдаться по любой паре хромосом, а поэтому возможна одновременная анеуплоидия по нескольким парам негомологичных хромосом. Если добавление по одной хромосоме имеет место одновременно в двух парах хромосом, то соответственно пишут: 2ft + l + l, в трех — 2ft +1 + 1 + 1 и т. д.
Анеуплоидия не только приводит к изменению характера наследования признаков, но вызывает определенное изменение в фенотипе. На дрозофиле впервые были обнаружены организмы с недостачей одной из аутосом (моносомики 2/г— 1), у которых IV маленькая хромосома присутствует в единственном числе. Рецессивные гены этой хромосомы в результате отсутствия соответствующих доминантных аллелей проявились в диплоидном гибридном организме. Отсутствие этой хромосомы сказалось также в уменьшении размеров мухи, снижении ее плодовитости, изменении ряда морфологических признаков: крыльев, щетинок, глаз и др. Прибавка IV хромосомы (трисомия) также вызывает изменение ряда признаков.
Если потеря одной маленькой IV хромосомы не приводит к гибели мухи, то недостача одной из крупных хромосом II или III пары детальна. Это указывает на генетическую неравноценность отдельных хромосом.
Влияние анеуплоидии на признаки организма наиболее ярко было показано на дурмане, имеющем 2/г = 24. Установлено, что прибавка по одной хромосоме к каждой из 12 пар вызывает изменение определенных признаков растения, например уменьшение размера коробочки, изменение ее строения и т. д. Влияние трисомии по отдельным парам хромосом на выражение признаков у шпината Spinacia oleracea видно на рисунке 98.
Анеуплоиды описаны у пшеницы, кукурузы, табака, хлопчатника, мыши, кошки, крупного рогатого скота и у многих других. Известны анеуплоиды и у человека. Как правило, они менее жизнеспособны, имеют меньшую продолжительность
§23

98. |

| Диплоидное и анеуплоидные растения шпината: в центре — диплоид, вокруг — трисомики по различным хромосомам (указаны их номера) . |
жизни, менее плодовиты, чем диплои-ды, и часто отличаются от последних морфологическими признаками. Известно, что анеуплоидия у растений менее сказывается на жизнеспособно-, сти, чем у животных.
У анеуплоидов образуются как
и aHevnттипиив п. нормальные, гаплоидные гаметы, так
мает vuar™ In Р" ЭТ°М У Растений в оплодотворении прини-ром хромосом я ,°я ПЫЛЬЦЗ С н°Рмальным, гаплоидным набором хромосом, а зародышевые мешки функционируют нечя висимо от числа хромосом, поэтому характер расщепления
плоид0оМвСТНяппеуПЛ°ИДОВ РеЗК° отличае™ отрасще'пления у Ди-плоидов. Например, если растение клевера - трисомик по хоо мосоме, несущей ген красной (А) или белой (а) окраски цве?-
Z^nTnT^J^ В СЛуЧЗе -моопьшен1я^0оКлРуачитсЯЦрВае -щепление 17. 1. Это объясняется тем, что функционирующая
нпм^ав°9бра3уе,ТСЯ ДВУХ С°РТ0В А и а' но пыльцевых зерРенсЩге ном А в 2 раза больше, чем с а. Яйцеклетки образуются четырех
224
сортов (А, а, АА, Аа) в следующей пропорции: \АА : \а :2А : :2Аа. По решетке Пеннета легко получить соотношение 17 : 1. В настоящее время исследование анеуплоидии у растений приобретает важное значение в связи с выяснением роли каждой хромосомы в генотипе. В будущем это поможет экспериментальному синтезу определенных генотипов. Анеуплоидия играет огромную роль в эволюции генотипа и имеет большое значение для изучения происхождения культурных растений. Однако эти вопросы нуждаются в дальнейшей усиленной разработке.
5. ЦИТОПЛАЗМАТИЧЕСКИЕ МУТАЦИИ
Понятие о цитоплазматических мутациях. Изменения плаз-могенов, приводящие к изменению признаков и свойств организма, называются цитоплазматическими, или плазменными мутациями. Изучение цитоплазматических мутаций осложнено трудностями их точной локализации, Как уже было отмечено, в настоящее время плазмогены локализованы только в пластидах и митохондриях, в остальных же органоидах наличие их не доказано. С другой стороны, есть плазмогены, локализовать которые вообще не удалось, например ЦМС у кукурузы и некоторые другие (см. гл. 10).
Цитоплазматические мутации имеют сходство с генными: они стабильны и передаются из поколения в поколение. Однако обнаружение их затруднено, так как одноименные цитоплазматические структуры встречаются в клетке в большом количестве. Для того чтобы рецессивная мутация проявилась в фенотипе, необходимо, чтобы все соответствующие цитоплазматические структуры в клетке были мутантными. Скорость разделения мутантных и немутантных структур в митозе зависит от общего числа этих структур в клетке.
Природа цитоплазматических мутаций. Природа цитоплазматических мутаций может быть различной. Известны два типа изменений. К первому типу относится утрата структур. Примером могут служить мутантные штаммы эвглены (Euglena mesnili), которые при длительном культивировании в темноте утрачивают пластиды (пластидная мутация). Утрата пластид является необратимой и приводит к изменению ряда свойств этих жгутиковых. Ко второму типу относятся мутанты, у которых цитоплазматические структуры функционально или морфологически изменены. Примером могут быть «дыхательные» мутации у дрожжей и нейроспоры (см. гл. 10). На электронных микрофотографиях мутантных и нормальных клеток видно, что митохондрии их по морфологии не отличаются друг от друга. Специальными исследованиями было показано, что митохондрии мутантных штаммов дрожжей не содержат цитохромоксидазы.
225
Изменения плазмогенов, очевидно, могут быть связаны с изменениями структуры ДНК митохондрий, но о них пока ничего не известно.
Мутантные плазмогены могут быть рецессивными или доминантными. Рецессивные плазмогены сохраняются и воспроизводятся в клетке, хотя их проявление и подавляется доминантными.
Цитоплазматические мутации, определяющие фенотип пластид, возникают спонтанно у всех зеленых растений. Частота возникновения их очень невелика. Так, у энотеры около 0,02% растений содержат отдельные клетки или участки тканей, которые имеют мутантные желтые или белые пластиды, т. е. лишены нормальной зеленой окраски. Правда, есть растения (свекла, капуста и др.), которые имеют более высокую частоту подобных мутаций, а именно от 0,1 до 0,5%. Частота появления обратных цитоплазматических мутаций детально не изучена. Но сам факт обратного мутирования (возникновения нормальных пластид из аномальных) можно считать установленным.
Частота мутаций плазмогенов у растений резко увеличивается при облучении семян рентгеновскими лучами или при действии радиоактивных изотопов (например, S35 или Р32). Индуцировать мутации плазмогенов можно с помощью ультрафиолетовых лучей, высоких и низких температур и других воздействий.
Особенности плазмогенов. Некоторые химические вещества способны вызывать цитоплазматические мутации в большом числе обрабатываемых клеток. В этом отношении плазмогены коренным образом отличаются от хромосомных генов, у которых мутации при действии этих же агентов возникают с частотой Ю-6 и реже.
К числу химических веществ, действующих на плазмогены, относятся акридиновые красители. Так, эуфлавин вызывает появление карликовых мутаций в большом числе обработанных дрожжевых клеток.
В некоторых очень редких случаях мутации, возникающие в ответ на изменения внешней среды, являются до некоторой степени адаптивными, по крайней мере при тех условиях, которые вызвали их появление. Так, наряду с другими мутациями стрептомицин способствует появлению среди чувствительных клеток хламидомонад (Chlamydomonas reinhardi) устойчивых— способных жить на среде со стрептомицином.
Способность плазмогенов к реверсии и к дальнейшим изменениям создает возможность адаптации организмов и при последующем изменении условий внешней среды. Таким образом наличие цитоплазматических мутаций еще больше обогащает генофонд вида и служит дополнительным резервом изменчивости в эволюции,
6. НЕКОТОРЫЕ МЕТОДЫ УЧЕТА МУТАЦИЙ
Особенности методов учета мутаций. Методы обнаружения мутаций должны быть разными в зависимости от особенностей объекта — главным образом способа размножения организма. Характер проявления мутации также определяет метод ее обнаружения. Некоторые видимые морфологические изменения можно учитывать довольно точно; несколько более сложным является определение физиологических и биохимических изменений у многоклеточных организмов. Легче всего обнаруживаются видимые доминантные мутации, которые могут проявляться в гетерозиготном состоянии в первом же поколении, труднее анализировать рецессивные мутации, их необходимо переводить в гомозиготное состояние. Для выявления последних требуется специальный генетический анализ в ряду поколений.
Для хорошо изученных в генетическом отношении объектов (дрозофила, кукуруза, ряд микроорганизмов) с установленными группами сцепления изучение новой мутации проводить довольно легко. Для этих объектов разработаны специальные методики учета частоты мутаций.
Учет видимых мутаций у дрозофилы. Для обнаружения видимых мутаций в половой хромосоме у дрозофилы используется методика сцепленных Z-хромосом — уу (см. гл. 8). При данной схеме скрещивания можно обнаружить видимые рецессивные, сцепленные с полом мутации, возникшие в половых клетках отцовского организма, по проявлению их у самцов в Fh
Учет рецессивных, сцепленных с полом летальных мутаций у дрозофилы. Наиболее объективно можно учитывать рецессивные летальные мутации, приводящие в гомозиготном состоянии к смерти несущих их особей. Для учета мутаций в половой хромосоме самца дрозофилы Г. Мёллером была разработана методика С1В (си-эль-би), схема которой приведена на рисунке 99.
Генетическая структура линии С1В состоит в том, что одна из Z-хромосом самки маркирована доминантным геном Ваг (полосковидные глаза). В этой же хромосоме имеется инверсия, обозначаемая буквой С. Эта инверсия препятствует кроссинго-веру и обладает рецессивным летальным эффектом /, т. е. зиготы, несущие две такие Х-хромосомы, погибают. Этими тремя начальными буквами (С1В) и обозначена линия — анализатор летальных мутаций в половых хромосомах самца дрозофилы. Другая Х-хромосома самки несет гены дикого типа. Отсутствие кроссинговера у гетерозиготных особей необходимо для того, чтобы деталь сохранялась в той же хромосоме.
При отсутствии летальной мутации в Х-хромосоме исходного самца из поколения в поколение поддерживается соотношение полов 2 9 :1 сГ за счет гибели самцов, получивших хромосому С1В (с летаЛью) от матери. Благодаря этому самцы
226
227

|
|
|
|
|
| Гаметы CLB |
| Га меть/ Р |
| CLB |
| F, |
| шъ |
| %оу |
| CLB |
| \-±------------------- 1 |
| * |
| «fcli^tylL qlgj |
|
|
Q9, всегда имеют круглые глаза. В слу-
| Метод обнаружения рецессивных сцепленных с полом летальных мутаций у дрозофилы (метод С1В): 1 — результаты скрещивания в случае отсутствия летальной мутации в j-хромосоме спермы самца; 2 — то же в случае ее наличия; С —инверсия; I — ле-таль; В — полосковидиые глаза. |
чае если в одном из спермиев анализируемого самца в Х-хромосоме возникает летальная мутация, то при оплодотворении таким спермием яйцеклетки с Х-хромосомой С1В (если эти летали неидентичны) развивается гетерозиготная по двум деталям самка, имеющая полосковидиые глаза. Если такой спермий оплодотворит яйцеклетку с Х-хромосомой дикого типа, то развивается гетерозиготная по летали самка дикого типа. На рисунке 99 видно, что в Fi будут встречаться самки двух типов: с нормальными (круглыми) и с полосковидными глазами (Ваг). Самцы, несущие хромосому С1В, гибнут, так как у них деталь находится в геми-зиготном состоянии. Поэтому самцы в F\ только одного типа — с нормальными глазами. Для дальнейшего анализа самок F\ с полосковидными глазами скрещивают индивидуально с нормальными самцами (каждая пара в отдельной пробирке).
Если самка Fi получила Х-хромосому анализируемого самца с летальной мутацией и, следовательно, стала гетерозиготной по двум деталям в обеих Х-хромосомах, то в потомстве F2 такой
| ZCyL ОСуЧ* |
ZCyL I Cy+L
| 100. Метод обнаружения рецессивных летальных мутаций в аутосомах у дрозофилы (метод сбалансированных деталей Су L Рт): I — результаты скрещивания в случае отсутствия летали во II хромосоме спермы самца; 2 — то же в случае ее наличия; Су* — нормальные крылья; Су — загнутые крылья, летален в гомозиготном состоянии; I — нормальные глаза; L — лопастные глаза, летален в гомозиготном состоянии; Рт* — красные глаза; Рт — коричневые глаза; для удобства в схеме обозначены только аллелн Су, L и Рт. |
самки не появится самцов, так как все они погибнут. Отсутствие самцов в F2 — показатель наличия мутации.
Учет рецессивных аутосомных летальных мутаций у дрозофилы. Для учета летальных мутаций в аутосомах дрозофилы существует другая методика, представленная на рисунке 100. Для проявления рецессивной летальной мутации в аутосоме тоже необходимо, чтобы она оказалась в гомозиготном состоянии. В этом случае учет возникающих рецессивных летальных мутаций производится в Fs. Для этой цели у дрозофилы можно использовать специально созданную линию, позволяющую учитывать летальные мутации во второй паре аутосом. В этой линии одна из хромосом содержит две большие инверсии — по одной в каждом плече, с видимым
228
229

|
| 101. Схема генетического анализа транслокаций: / — результаты скрещивания |
доминантным эффектом: Су (загнутые крылья) й L (лопастные глаза), каждая из них в гомозиготном состоянии вызывает летальный эффект; гомологичная хромосома также содержит инверсию Рт (коричневые глаза). Этот метод обнаружения мутаций иногда называют метод CyL/Pm.
Испытываемого самца скрещивают с самкой из линии CyLIPm.
Из F\ выбирают гетерозиготных самцов CyL, а не самок, поскольку у самцов кроссинговер подавлен и возникшая деталь сохраняется в той же хромосоме. Каждого такого самца, несущего по одной анализируемой хромосоме и хромосоме CyL, индивидуально скрещивают с самкой исходной линии CyL/Pm. Во втором поколении половина мух (самцов и самок) в каждой культуре оказывается гетерозиготной по одной и той же анализируемой хромосоме, но половина из них имеет признаки CyL, а половина Рт. 'Д мух, гомозиготных по CyL, погибает, а-'Д мух, имеющих признаки CyL/Pm, не несет анализируемой хромосомы. Поэтому для дальнейшего анализа берут только самок и самцов с признаками CyL и скрещивают их между собой. В F3 в случае отсутствия летальной мутации в анализируемой хромосоме происходит расщепление в отношении 2CyL:\Cy+L+, так как гомозиготные мухи CyL не выживают. Если в анализируемой хромосоме имеется деталь, то в культуре ^з будут мухи одного фенотипа — CyL, а нормальные по фенотипу будут погибать в силу гомозиготного состояния рецессивной летальной мутации.
Учет мутаций у других объектов. Аналогичные методы обнаружения мутаций разработаны и для других объектов (мышь и др.). В основу их положены те же принципы: 1) обнаружить рецессивную мутацию можно, переведя ее в гомо- или гемизи-готное состояние, 2) учесть точно частоту возникающих мутаций можно лишь при условии отсутствия кроссинговера у гетерозиготных особей.
Методы обнаружения мутаций у микроорганизмов будут рассмотрены в главе 15.
Для млекопитающих (мышь, кролик, собака, свинья и др.) наиболее удовлетворительно разработана методика учета частоты возникновения доминантных летальных мутаций. О частоте мутаций судят по разнице между числом желтых тел в яичнике и развивающихся эмбрионов у вскрытой беременной самки.
Учет частоты возникновения мутаций у человека очень затруднен, однако генеалогический анализ, т. е. анализ родословных, позволяет устанавливать возникновение новых мутаций. Если в родословной супругов в течение нескольких поколений не встречался какой-то признак, а у одного из детей он появился и стал стойко передаваться следующим поколениям, то можно
230
| 1 ••/ |
/•■/•/ 1
говорить о возникновении мутации в гамете одного из этих супругов (подробнее см. гл. 29).
| в норме; 2 — то же при наличии транслокаций; dp — нормальные крылья: dp — укороченные крылья; е — серое тело; е — темное тело. |
Учет хромосомных перестроек. Летальные мутации, обнаруживаемые генетическими методами, по геноти-пической природе могут быть различными. Сюда относятся как разного рода хромосомные перестройки, так и изменения отдельных генов.
Учет частоты хромосомных перестроек определенного типа можно проводить, используя цитологические методы. У дрозофилы и других двукрылых насекомых анализируются гигантские хромосомы слюнных желез, у растений или в культуре тканей животных и человека можно анализировать хромосомы в метафазе и анафазе митоза и по наличию мостов и фрагментов судить о наличии хромосомных перестроек.
Метод учета транслокаций, возникающих в половых клетках самца дрозофилы, изображен на рисунке 101. Если анализируется транслокация между II и III хромосомами, то для скрещивания берется линия дрозофилы, маркированная любыми рецессивными генами в названных хромосомах. Например, одна
т
 пара генов — укороченные крылья dp находится во II группе сцепления, а другая —темно-серое тело е— в III. С гомозиготной по этим генам самкой скрещивается самец дикого типа, половые клетки которого анализируются на наличие в них взаимной транслокации между II и III парами хромосом. Из F\ берут самцов, гетерозиготных по указанным генам, и индивидуально скрещивают их с самками из линии с двумя парами рецессивных генов (анализирующее скрещивание). В том случае, когда в половых клетках анализируемого нормального самца нет реципрокной транслокации между II и III хромосомами, расщепление в потомстве соответствует нормальному отношению 1:1:1:1. В случае же, когда в одном из сперматозоидов нормального самца произошла транслокация, расщепление в потомстве этого самца изменяется. Допустим, что в результате транслокации к II хромосоме прикрепился большой фрагмент III хромосомы с локусом е+, а к III —малый немеченый фрагмент II хромосомы. Сочетание такой мужской гаметы с женской, несущей оба рецессивных гена dp и е, дает гетерозйготу по ука-
пара генов — укороченные крылья dp находится во II группе сцепления, а другая —темно-серое тело е— в III. С гомозиготной по этим генам самкой скрещивается самец дикого типа, половые клетки которого анализируются на наличие в них взаимной транслокации между II и III парами хромосом. Из F\ берут самцов, гетерозиготных по указанным генам, и индивидуально скрещивают их с самками из линии с двумя парами рецессивных генов (анализирующее скрещивание). В том случае, когда в половых клетках анализируемого нормального самца нет реципрокной транслокации между II и III хромосомами, расщепление в потомстве соответствует нормальному отношению 1:1:1:1. В случае же, когда в одном из сперматозоидов нормального самца произошла транслокация, расщепление в потомстве этого самца изменяется. Допустим, что в результате транслокации к II хромосоме прикрепился большой фрагмент III хромосомы с локусом е+, а к III —малый немеченый фрагмент II хромосомы. Сочетание такой мужской гаметы с женской, несущей оба рецессивных гена dp и е, дает гетерозйготу по ука-
dp e^
занной транслокации: ~, , — •
dp+e^
У самца этого типа образуется четыре сорта гамет. При скрещивании его с самкой, гомозиготной по обоим рецессивным генам, дающей гаметы лишь одного сорта, в потомстве обнаруживается ненормальное расщепление. Так как зиготы, имеющие недостачу или излишек генного материала, не выживают, то особи с фенотипом dpe+ или dp+e в потомстве отсутствуют. Нарушение генного баланса приводит к тому, что в FB появляются не четыре фенотипических класса, а только два, т. е. наблюдается расщепление в отношении 1:1.
7. СПОНТАННЫЙ МУТАЦИОННЫЙ ПРОЦЕСС И ЕГО ПРИЧИНЫ
Частота мутаций и их причины. Под термином «спонтанная мутационная изменчивость» обычно объединяются мутации, которые возникают в естественных условиях без специального воздействия необычными агентами. Мутационный процесс характеризуется главным образом частотой возникновения мутаций. Определенная частота возникновения мутаций характерна для каждого вида животных, растений и микроорганизмов: одни виды обладают более высокой мутационной изменчивостью, чем другие.
В настоящее время еще нет исчерпывающих сведений об общей частоте возникновения мутаций за одно поколение. Это объясняется тем, что мутации чрезвычайно разнообразны как по фенотипическому проявлению,, так и по генетической обусловленности, а методы их учета несовершенны; лишь в отноще-
232
нйи мутабильности отдельных локусов можно Дать более или менее точную оценку. Как правило, одновременно мутирует лишь один из членов аллелыюй пары; одновременное мутирование обоих членов маловероятно.
Установленные закономерности частоты спонтанного мутирования сводятся к следующим положениям: различные гены в одном генотипе мутируют с разной частотой (имеются гены мутабильные и стабильные); сходные гены в разных генотипах мутируют с различной частотой.
Эти два положения иллюстрируются таблицей 11. В ней сравнивается частота мутирования генов у разных видов животных, растений и человека, а у кукурузы — частота мутирования одних и тех же генов в линиях, имеющих разные генотипы.
Таблица 11
Частота спонтанных мутаций разных генов у разных видов и сходных генов в различных генотипах (кукуруза)
| Вид и линия | Прямая мутация | Частота иа 10 000 гамет |
| Кукуруза То же, колумбийская линия То же, корнельская линия Дрозофила Человек | / Wx-+wx \ Рг -> рг \ Ir ->ir \ Rr -*/ RT -+rr ( ct+ ->ct 1 У+ -+У Гемофилия Мышечная дистрофия Хоидродистрофия | 0,001 0,11 1,06 6,20 18,20 1,50 0,29 0,32 0,08 1,40 |
Из таблицы 11 видно, что один и тот же ген Rr, определяющий антоциановую окраску, в двух линиях кукурузы мутирует к гг по-разному: в одной — с частотой 6,2, а в другой—18,2 на 10 000 гамет. Установлено также, что частота возникновения летальных мутаций у разных линий дрозофилы различна.
Каждый ген мутирует относительно редко, но так как число генов в генотипе огромно, то суммарная частота мутирования всех генов оказывается довольно высокой. Для дрозофилы расчет показывает, что одна мутация происходит примерно на 100 гамет за одно поколение, для других организмов известна и более высокая частота; 1 мутация на 10—30 гамет.
С помощью селекции можно создать линии, которые будут иметь разную спонтанную мутабильность. В пользу этого говорит тот факт, что существуют особые гены— мутаторы, которые
233

 влияют на скорость Мутирования Других генов. Гак, например, у кукурузы есть ген Dt, который влияет на мутабильность гена а. У растений с генотипом аа DtDt на фоне неокрашенных антоцианом .тканей появляются окрашенные участки (соматические мутации от а к Л), в то время как у растений aadtdt подобное явление не встречается. Влияние генотипа на спонтанную мутабильность отдельного гена проявляется также при гибридизации. Имеются указания на то, что частота мутирования одного и того же локуса выше у гибридных организмов, чем у исходных форм.
влияют на скорость Мутирования Других генов. Гак, например, у кукурузы есть ген Dt, который влияет на мутабильность гена а. У растений с генотипом аа DtDt на фоне неокрашенных антоцианом .тканей появляются окрашенные участки (соматические мутации от а к Л), в то время как у растений aadtdt подобное явление не встречается. Влияние генотипа на спонтанную мутабильность отдельного гена проявляется также при гибридизации. Имеются указания на то, что частота мутирования одного и того же локуса выше у гибридных организмов, чем у исходных форм.
Спонтанный мутационный процесс обусловлен также физиологическим состоянием и биохимическими изменениями в клетках. Так, например, М. С. Навашин и Г. Штуббе показали, что в процессе старения семян при хранении в течение нескольких лет частота мутаций, особенно типа хромосомных перестроек, значительно увеличивается.
Одной из возможных причин спонтанного мутирования может быть накопление в генотипе мутаций, блокирующих биосинтез тех или иных веществ, вследствие чего будет происходить чрезмерное накопление предшественников таких веществ, которые могут обладать мутагенными свойствами.
Закон гомологических рядов наследственной изменчивости. Изучение наследственной изменчивости у различных систематических групп растений позволило Н. И. Вавилову сформулировать закон гомологических рядов. Вот этот закон.
Виды и роды, генетически близкие, характеризуются сходными рядами наследственной изменчивости с такой правильностью, что, зная ряд форм в пределах одного вида, можно предвидеть нахождение аналогичных форм у других видов и родов. Чем ближе генетически в общей системе роды и виды, тем полнее сходство в рядах их изменчивости. Целые семейства растений характеризуются определенным циклом изменчивости, проходящей через все роды и виды, их составляющие.
Закон гомологических рядов Вавилов выразил формулой:
Giia+b + c ...) Gt(a+b + c . . .) G3(a+b + c . . .)
где Gi, G2, G3 обозначают виды и a, b, с... — различные варьирующие признаки, например окраску, форму стеблей, листьев, семян и др.
Иллюстрацией к закону может служить таблица 12, где показана гомология наследственной изменчивости по некоторым признакам и свойствам в пределах семейства злаковых.
В настоящее время с полным основанием можно сказать, что у родственных видов, имеющих общее происхождение, возни-
234
кают и сходные мутации. Более того, даже у представителей разных классов животных мы встречаем параллелизм — гомолог гические ряды мутаций по морфологическим, физиологическим и особенно биохимическим признакам и свойствам. Так, например, у разных классов позвоночных встречаются сходные мутации: альбинизм и бесшерстность у млекопитающих, альбинизм и отсутствие перьев у птиц, отсутствие чешуи у рыб, коротконо-гость у крупного рогатого скота, овец, собак, птиц, насекомых и т. д. Гомологические ряды мутационной изменчивости биохимических признаков встречаются у простейших и микроорганизмов.
Таблица 12
Общая схема сортовой (расовой) изменчивости видов семейства Gramineae
| Наследственно варьирующие | ее | Л | |уза | ГГЛ | |||||||
| признаки растения | ожь | теш | чмен | вес | о и о о. | орго | о. >. X | а | ырей | ||
| О. | С | t* | О | С | U | » | о. | С | |||
| Соцве- | Плеичатость | пленчатое | + | + | + | + | + | + | + | + | + |
| тие | зерна | голое | + | 4- | + | + | -4- | + | + | + | + |
| Остистость | остистое | + | + | + | + | + | + | + | + | ||
| безостое | + | + | + | + | + | 4- | + | + | + | ||
| Зерно | Окраска | белая | + | + | + | + | + | + | + | + | ' + |
| красная | + | + | + | 4- | + | + | + | ||||
| зеленая (серо-зеленая) | + | + | + | + | + | + | + | + | |||
| черная (темно-серая) фиолетовая | + | + | + | + | + | + | |||||
| (антоциановая) | + | + | + | + | + | + | |||||
| Форма | округлая | + | + | + | + | + | + | + | + | ||
| удлиненная | + | + | + | + | + | + | + | + | + | ||
| Консистенция | стекловидная | + | + | + | + | + | + | + | + | + | |
| мучнистая (крахмалистая) | + | + | + | + | + | + | + | + _ | + | ||
| Биологи- | Образ жизии | озимый | + | + | + | + | + | ||||
| ческие | яровой | + | •4- | + | + | + | + | + | + | ||
| призна- | Скороспелость | поздняя | + | + | + | + | + | + | + | + | + |
| ки | ранняя | 4- | .+ | '+ | + | + | + | + | + | + | |
| Холодостой- | низкая | + | + | + | + | + | + | + | + | ||
| кость | высокая | + | + | ■ 4- | + | + | + | + | 4- | + | |
| Отзывчивость | » | + ■ | ■+ | + | + | + | |||||
| на удобрения | низкая | + | + | + | + | + | |||||
Примечание. Знаком плюс обозначены формы, обнаруженные Н. И. Вавиловым в 1935 г.
Исходя из закона гомологических рядов, следует принять, что если обнаруживается ряд спонтанных или индуцированных мутаций у одного вида животного или растения, то можно ожидать сходный ряд мутаций и у других видов этого рода. То же относится и. к более высоким систематическим категориям.
Наиболее вероятное объяснение происхождения гомологических рядов наследственной изменчивости сводится к следующему. Родственные виды внутри одного рода, роды внутри
235
 одного отряда или семейства могли возникнуть посредством отбора различных полезных мутаций отдельных общих генов, отбора форм с различными полезными хромосомными перестройками. В этом случае родственные виды, разошедшиеся в эволюции за счет отбора разных хромосомных перестроек, могли нести гомологичные гены, как исходные, так и мутантные. Виды могли возникать также путем отбора спонтанных полиплоидов, содержащих однородные наборы хромосом.
одного отряда или семейства могли возникнуть посредством отбора различных полезных мутаций отдельных общих генов, отбора форм с различными полезными хромосомными перестройками. В этом случае родственные виды, разошедшиеся в эволюции за счет отбора разных хромосомных перестроек, могли нести гомологичные гены, как исходные, так и мутантные. Виды могли возникать также путем отбора спонтанных полиплоидов, содержащих однородные наборы хромосом.
Дивергенция видов, идущая на основе этих трех типов наследственной изменчивости, обеспечивает общность генетического материала у родственных систематических групп. В действительности дело обстоит сложнее, чем нам это сейчас представляется. Однако эта проблема уже сейчас должна заставить исследователей искать не столько частные различия, характеризующие дивергенцию видов, сколько их общие черты, в основе которых лежат аналогичные генетические механизмы.
8. ИНДУЦИРОВАННЫЙ МУТАЦИОННЫЙ ПРОЦЕСС И ЕГО ЗАКОНОМЕРНОСТИ
Факторы, индуцирующие мутации. Под индуцированным мутационным процессом понимают возникновение наследственных изменений под влиянием специального воздействия факторов внешней и внутренней среды.
Первые исследования, относящиеся к изучению влияния различных факторов (мутагенов) на наследственную изменчивость, появились в начале нашего столетия. В настоящее время убедительно доказано влияние температуры, ультрафиолетовых и рентгеновских лучей, химических веществ и других агентов на возникновение мутаций. Наибольший успех достигнут в изучении действия ионизирующих излучений.
Действие ионизирующих излучений. В нашей стране Г. А. Надсоном и Г. С. Филипповым в 1925 г. было впервые показано влияние лучей радия на наследственную изменчивость у грибов. Однако наиболее убедительное доказательство влияния рентгеновских лучей на наследственную изменчивость было получено Г. Мёллером в 1927 г. благодаря созданию специального метода учета числа возникающих мутаций у дрозофилы (метод С1В). Было показано, что облучение увеличивает частоту воз^ никновения мутаций в сотни раз по сравнению со спонтанной частотой. Позднее рядом исследователей (Л. Стадлером, А. А. Сапегиным и др.) было установлено влияние радиации на возникновение мутаций у высших растений — кукурузы, табака, ячменя, пшеницы.
Возник новый раздел генетики — радиационная генетика. Исследованию влияния ионизирующих агентов на мутационный процесс уделяется и сейчас большое внимание. Это определяется
тем значением, которое ионизирующие излучения приобрели в жизни человека в последние десятилетия. К сожалению, далеко не все представляют себе, насколько тяжелы последствия повышения фона радиации. Под влиянием даже незначительной дозы ионизации резко возрастает частота мутаций. Подавляющее большинство мутаций порождает различные наследственные уродства и болезни. Накапливаясь в поколениях, они могут принести большие страдания человечеству. И обязанность современного общества состоит в том, чтобы не только сохранить жизнь и здоровье ныне живущего поколения, но и оградить будущие поколения от отягощения вредными мутациями.
Вместе с тем ионизирующие излучения с большим успехом используются в селекции и медицине, они широко применяются для изучения мутационного процесса.
При исследовании действия ионизирующих излучений на клетку было показано, что ядро примерно в 100 000 раз чувствительнее к радиации, чем цитоплазма. Поражаемость ядра клетки ионизирующими излучениями, так же как и другими агентами, может быть обусловлена высокой чувствительностью хромосом, а также тем, что они уникальны. ДНК хромосом является одним из самых чувствительных компонентов клетки. Меньшая чувствительность цитоплазмы может быть обусловлена также наличием в ней множественных одноименных структур, заменяющих друг друга.
После облучения в клетках наблюдаются самые разнообразные обратимые и необратимые изменения: возникают клетки с гигантскими ядрами, многоядерные клетки, нарушается полярность при делении ядра, тормозится митотическая активность, происходит слипание хромосом (пикноз) или их фрагментация и др. Во время деления облученной клетки в анафазе часто образуются хромосомные мостики, что может быть следствием хромосомных перестроек или слипания хромосом. Нарушение нормального хода митоза под влиянием облучения может приводить к возникновению полиплоидных, гаплоидных или анеу-плоидных клеток.
Примеры описанных изменений приведены на рисунке 102, по данным И. И. Соколова. На рисунке показаны лишь типичные патологические состояния ядра и хромосом, возникающие в облученных клетках. При облучении в большом количестве возникают летальные, полулетальные (понижающие жизнеспособность) и другие мутации, вызывающие гибель зигот. Такие мутации могут быть доминантными и рецессивными.
На основании количественного учета мутаций была установлена зависимость частоты их возникновения от дозы облучения. Многочисленные опыты с дрозофилой, кукурузой, ячменем и другими объектами позволили сделать вывод, что частота генных мутаций возрастает прямо пропорционально дозе
236
237
 ионизирующего излучения. Указанную зависимость можно изобразить графически. На оси абсцисс откладывают дозы облучения, а на ординате — частоты обнаруженных мутаций. В этом случае график зависимости частоты мутаций от дозы облучения будет иметь вид прямой линии, почему и говорят о «линейной зависимости» (рис. 103,1). Продолженная влево за точку, соответствующую минимальной дозе, изученной в опыте, эта линия пройдет через нулевую точку координат. Это говорит о том, что любая малая доза ионизирующей радиации может приводить к повышению частоты мутаций. Вывод об отсутствии порога генетического эффекта ионизирующей радиации, сделанный на основе такой экстраполяции, получил теперь прямое подтверждение в опытах с малыми дозами. В настоящее время можно утверждать, что при любой малой дозе облучения повышение ее в 2 раза удваивает частоту возникновения мутаций. Интересно отметить, что равные дозы ионизирующих излучений, различающиеся по интенсивности (доза в единицу времени) в 10 000 и даже 100 000 раз, вызывают генные мутации с одинаковой частотой.
ионизирующего излучения. Указанную зависимость можно изобразить графически. На оси абсцисс откладывают дозы облучения, а на ординате — частоты обнаруженных мутаций. В этом случае график зависимости частоты мутаций от дозы облучения будет иметь вид прямой линии, почему и говорят о «линейной зависимости» (рис. 103,1). Продолженная влево за точку, соответствующую минимальной дозе, изученной в опыте, эта линия пройдет через нулевую точку координат. Это говорит о том, что любая малая доза ионизирующей радиации может приводить к повышению частоты мутаций. Вывод об отсутствии порога генетического эффекта ионизирующей радиации, сделанный на основе такой экстраполяции, получил теперь прямое подтверждение в опытах с малыми дозами. В настоящее время можно утверждать, что при любой малой дозе облучения повышение ее в 2 раза удваивает частоту возникновения мутаций. Интересно отметить, что равные дозы ионизирующих излучений, различающиеся по интенсивности (доза в единицу времени) в 10 000 и даже 100 000 раз, вызывают генные мутации с одинаковой частотой.
Многочисленными работами Н. В. Тимофеева-Ресовского и его сотрудников было показано, что фракционирование одной и той же дозы не влияет на частоту возникновения точковых мутаций. Так, например, облучение рентгеновскими лучами в одной и той же дозе 1000 р, непрерывное в один сеанс или фракционированное — с интервалами в несколько часов, суток и даже недель, вызывает одинаковый процент мутаций.
Далее было установлено, что частота точковых мутаций не зависит от длины волны рентгеновских лучей.
На основании этих и ряда других данных Н. В. Тимофеев-Ресовский в сотрудничестве с физиком К. Циммером еще в 1936 г. предложил гипотезу, вошедшую в литературу под названием
 теории мишени. Эта гипотеза построена на признании принципа случайного попадания кванта энергии в ген. При этом происхо-
теории мишени. Эта гипотеза построена на признании принципа случайного попадания кванта энергии в ген. При этом происхо-
103.
| Ш0 6000 8000 Доза, р |
Зависимость частоты рецессивных, сцепленных с полом летальных мутаций у дрозофилы '(/) и хромосомных перестроек у традесканции (2) от дозы облучения:
/— прямо пропорциональная зависимость; 2 — экспоненциальная.
дит Ионизация атома и ген мутирует с вероятностью, близкой к 1. Исходя из такого чисто физического представления, Тимофеев-Ресовский объяснял линейную зависимость частоты возникновения мутаций от дозы излучения. При этом предполагалось, что ген мутирует необратимо по принципу все или ничего. Ген принимался за мишень с определенным «чувствительным объемом». Поглощенная в пределах этого объема энергия «попавшего» кванта может «мигрировать» и вызвать изменение гена или разрыв хромосомы, который может привести к хромосомным перестройкам. Структурные изменения хромосомы, возникающие вследствие одного разрыва, называют одноударными хромосомными перестройками, структурные изменения вследствие двух одновременных разрывов — двухударными и т. д. Частота возникновения разных типов хромосомных перестроек находится в различной зависимости от дозы ионизирующей радиации. Частота одноударных хромосомных перестроек (происходящих в результате одиночного разрыва) находится в прямолинейной зависимости от дозы. Частота же двухударных перестроек возрастает пропорционально квадрату дозы, вследствие того что вероятность одновременного возникновения двух независимых событий равна произведению вероятностей (рис. 103,2). Такая зависимость возможна при условии, что разные дозы ионизации вызывают с одинаковой вероятностью разрывы хромосом в расчете на единицу дозы.
Прямыми цитологическими исследованиями — подсчетом клеток с нарушенными хромосомами — показано, что возникновение хромосомных перестроек зависит от плотности ионизации. Излучения с меньшей энергией и большей линейной плотностью ионизации более эффективны в вызывании хромосомных перестроек. В общей форме можно сказать, что корпускулярные излучения — быстрые нейтроны и сс-частицы вызывают хромосомные перестройки чаще, чем электромагнитные излучения. Объяснить это можно тем, что для возникновения разрыва необходимо некоторое количество ионизации на единицу объема.
Теория мишени сыграла положительную роль в изучении проблемы. Лежащие в ее основе положения и до сих пор успешно применяются в радиобиологии и радиационной генетике и известны теперь в литературе как принцип попадания. Однако со временем «теория мишени» в той части, которая касалась механизма возникновения мутаций, вступила в противоречие с вновь открытыми фактами. Оказалось, что на частоту возникновения обнаруживаемых хромосомных перестроек влияет фракционирование облучения, что связано с восстановительными процессами, идущими в клетке между двумя облучениями.
Было показано, что облучение дрозофилы и некоторых растений в атмосфере чистого кислорода повышает частоту мутаций, а облучение в атмосфере азота снижает их частоту.
238
239
 Бескислородная атмосфера оказывается в некоторой мере защитной при ионизирующем облучении клетки. Явление увеличения частоты мутаций при действии ионизирующей радиации в присутствии кислорода было названо кислородным эффектом. Влияние кислорода может быть двояким: он может способствовать возникновению мутаций или препятствовать их восстановлению.
Бескислородная атмосфера оказывается в некоторой мере защитной при ионизирующем облучении клетки. Явление увеличения частоты мутаций при действии ионизирующей радиации в присутствии кислорода было названо кислородным эффектом. Влияние кислорода может быть двояким: он может способствовать возникновению мутаций или препятствовать их восстановлению.
При количественном анализе частоты возникновения различных хромосомных перестроек встречаются трудности, заключающиеся в том, что реализуется лишь незначительная часть возникающих под лучом разрывов, а остальные либо залечиваются с восстановлением исходных структур, либо элиминируются.
В настоящее время доказано мутагенное действие ультрафиолетовых лучей (УФ) для многих организмов. Они вызывают все виды мутаций. Самой интересной особенностью действия УФ-лучей является то, что наибольшая эффективность их связана с определенным спектром длин волн, а именно с областью
о
от 2500 до 2800 А (рис. 104). Это открытие явилось важным моментом в понимании природы наследственной изменчивости. Дело в том, что нуклеиновые кислоты, составляющие основу хромосом, поглощают УФ с длиной волны как раз этой части спек-
о
тра, т. е. около 2600 А.
Исследование действия УФ и ионизирующих излучений на
мутационный процесс у бактерий показало, что облучение даже
не самого объекта, а лишь среды, на которой развиваются
клетки, может индуцировать мутации. Так, у кишечной палочки
(Escherichia coli) мутации, повышавшие устойчивость к стреп
томицину и пенициллину, возникали в 10—500 раз чаще, чем
спонтанные, если бактерии развивались на облученной УФ среде.
^ Это можно объяснить,
| 1 | 1Л | "9 \ | 1 | \ | ||||
| -J | '/ | \ \ - \ | 1 | \ | ||||
| 1 1 1 1 | \ | 1 1 | \ | \ | ||||
| < 1 | 1 | 1 1 | \ | \ | \ \ | |||
| 1 | ''г | \ \ \ X | \ | |||||
| ' | у | ■ |
*£,0° I—|—|---- [~Т"П—%—I---- 1-- 1 0ЧевиДн°1 тем> что облу-
| / \ /\ чение среды УФ вызывает
| '' \ I \ в ней образование актив-
"§ 80 7 * / \ ных соединений, которые
| / J \ оказываются мутагенами.
!_ s0_______ ^______ ft____ \_____ Такое опосредованное му-
| 104. Относительная эффектив гриб); 2 —Zea mays (кукуруза). |
I
I го
| 2200 2 Ш 2600 2800 «, Длина долны , А |
| 3000 |
I i
240
тагенное действие ионизирующей радиации недавно показано и на млекопитающих.
До сих пор мы рассматривали физическую сторону влияния ионизирующей радиации на возникновение мутаций. Но уже давно было установлено, что при облучении одной и той же дозой рентгеновских лучей половых клеток, 'находящихся на разных стадиях развития, частота выявляемых мутаций оказывается различной. Если одновременно облучить рентгеновскими лучами в дозе 2000 р сперматозоиды и сперматогонии, то частота летальных мутаций в первом случае может быть около 2,5%, а во втором —около 0,5%, т. е. в 5 раз ниже. Однако, при дозах в 20 раз меньших (100 р),наоборот,в хшерматогониях регистрируется в 4 раза больше мутаций, чем в сперматозоидах.
Наиболее вероятным объяснением этих фактов следует считать высокую чувствительность к ионизирующей радиации незрелых половых клеток по сравнению со зрелыми, в силу чего и элиминация при больших дозах среди них выше, чем среди зрелых клеток. При этом в первую очередь, вероятно, гибнут клетки, несущие хромосомные перестройки.
Главным барьером, отметающим хромосомные перестройки, образовавшиеся в сперматогониях, является мейоз, в профазе которого хромосомные аберрации нарушают нормальную конъюгацию хромосом; мейоз «пропускает» лишь определенную группу мутаций — точковые и сравнительно мелкие перестройки. Последнее предположение было подтверждено экспериментально на дрозофиле.
Цитологически на гигантских хромосомах было показано, что летальные мутации, изученные в сперматозоидах и спермати-дах, в значительной мере (20—38%) связаны с крупными хромосомными перестройками — транслокациями, делениями и инверсиями; мутации же, учтенные в сперматогониях при тех же условиях облучения, ни в одном случае не были связаны с крупными хромосомными перестройками.
Реакция клеток на облучение сильно зависит от их физиологического состояния. У самцов и самок одного вида животных наблюдается разная чувствительность клеток. Сухие семена растений менее чувствительны, чем намоченные, и т. д. Клетки разных тканей и клетки разного возраста одних и тех же тканей имеют различную чувствительность.
На различных стадиях митотического цикла чувствительность хромосом к облучению различна. Многие авторы считают, что наиболее высокая поражаемость хромосом наблюдается в интерфазе, так как при этом нарушается правильность репликации ДНК.
Эффективность ионизирующих излучений в отношении индуцирования генных мутаций и хромосомных перестроек может зависеть от генотипа.
" Генетика с основами селекции
241
 М. Л. Бельговским на насекомых, В. В. Хвостовой на растениях было установлено, что частота хромосомных перестроек для одних и тех же хромосом в клетках гибридов выше, чем у исходных видов. Ю. Я- Керкис с сотрудниками патогенетическими методами показали, что хромосомы мышей различных генетических линий обладают разной чувствительностью к малым дозам радиации.
М. Л. Бельговским на насекомых, В. В. Хвостовой на растениях было установлено, что частота хромосомных перестроек для одних и тех же хромосом в клетках гибридов выше, чем у исходных видов. Ю. Я- Керкис с сотрудниками патогенетическими методами показали, что хромосомы мышей различных генетических линий обладают разной чувствительностью к малым дозам радиации.
Возможно, зависимость мутагенного эффекта ионизирующей радиации от генотипа обусловлена не различным отношением хромосом к ионизации, а генами, которые определяют относительно различный химический состав ядра клетки, ее метаболизм, т. е. генотип определяет характер вторичных процессов.
Было показано, что при одной и той же дозе облучения различные гены мутируют с разной частотой. Например, у дрожжей (Saccharomyces cerevisiae) известны два локуса, контролирующих синтез аденина (ad\ и adz). При изучении частоты мутаций под влиянием рентгеновых и УФ-лучей установлено, что частота мутаций в локусе arf2 в два раза выше, чем в локусе adi. Даже перемещение гена из одного участка хромосомы в другой может сопровождаться изменением его мутабильности при действии мутагенных факторов.
Действие химических веществ. Изучение мутационного процесса показало, что любые факторы внешней и внутренней среды, выводящие организм из оптимального состояния, могут вызывать мутации. Многие химические вещества могут быть мутагенами. Химический мутагенез стал предметом изучения особого раздела генетики.
Изучение мутагенного эффекта химических веществ было начато давно. Первые экспериментальные работы, в которых был получен мутационный эффект под действием химических агентов, проведены в 1934 г. в Советском Союзе В. В. Сахаровым и М. Е. Лобашевым. Тогда же Лобашевым были предложены некоторые принципы выбора химических мутагенов, которые в дальнейшем оказались правильными. Так, указывалось, что химическое вещество, используемое в качестве мутагена, должно обладать высокой проникающей способностью, свойством изменять коллоидное состояние хромосом и определенным действием на химический состав хромосом.
Мутагенный эффект того или иного фактора может контролироваться приспособленностью к нему организма. Например, колхицин у растений вызывает полиплоидию, но он содержится в растении Colchicum (безвременник), не вызывая у него появления полиплоидных клеток.
И. А. Раппопортом в СССР и Ш. Ауэрбах в Англии были найдены мощные химические мутагены. К числу их относятся: формалин, иприт, уретан, этиленимин и др. Сравнение действия этих веществ с действием рентгеновских лучей показало, что
242
нет никаких принципиальных различий в характере вызываемых ими изменений — все они вызывают как генные мутации, так и хромосомные перестройки.
Эффективность и специфичность мутагенов. Большое значение имеет изучение комплексного действия внешних факторов на мутационный процесс. Убедительно показано, что существуют агенты (температура и др.), которые могут повышать или понижать эффект радиации. Ярким примером этого может служить ранее рассмотренный нами кислородный эффект.
Представляют большой интерес недавно полученные факты о влиянии вирусов и фагов на мутационный процесс у хозяев —■ бактерий, грибов, дрозофилы, человека и некоторых других ■ организмов. Эти открытия позволили выделить группу так называемых биологических мутагенов. Исследования в этой области только начинаются.
Эффективность разных мутагенных факторов может быть различной, и она определяется их химической и физической природой. Так, частота возникновения обратных мутаций, контролирующих синтез аденина у нейроспоры, колеблется от 152,0 (воздействие бромэтилметансульфонатом) до 3,2 (воздействие рентгеновскими лучами) на 106 конидий. Сходные данные получаются и у дрожжей. Однако при действии тех же агентов на другие локусы (синтез витамина) того же объекта (нейроспора) получается иная эффективность: так, при действии бромэтил-метансульфоната частота была 0,04, а при действии рентгеновских лучей — 0,20 на 106 конидий. Это говорит о специфичности реакции генов.
Изучение специфичности действия мутагенов приближает нас к раскрытию природы гена и к решению проблемы направленного его изменения. Решение проблемы управления наследственной изменчивостью откроет новую эру в развитии производительных сил общества.
* *
*
Итак, мутации (генные, хромосомные, геномные и цитоплаз-матические) возникают как спонтанно, так и под влиянием воздействий внешней среды. Для понимания природы мутационного процесса очень важно изучение индуцированных мутаций с помощью методов точного количественного учета.
Установлено, что частота, направление и специфичность мутаций зависят как от качеств воздействующих факторов, так и от физиологического состояния организмов (генотипа, фазы онтогенеза, пола, стадии гаметогенеза, состояния хромосом в цикле митоза или мейоза, химического строения отдельных локусов и т. д.).
9
Глава 14. МОДИФИКАЦИОННАЯ ИЗМЕНЧИВОСТЬ
Как уже было отмечено, организмы, имеющие одинаковые генотипы, но развивающиеся в различных условиях внешней среды, могут иметь разные фенотипы. Такое фенотипичное разнообразие особей называется модификационной изменчивостью.
Дата добавления: 2020-01-07; просмотров: 1037; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!