Глава 15. ХИМИЧЕСКИЕ ОСНОВЫ НАСЛЕДСТВЕННОСТИ
Прежде чем излагать современные представления о молекулярных основах наследственности, необходимо очень кратко осветить особенности микроорганизмов как объекта молекулярной генетики.
ОСОБЕННОСТИ МИКРООРГАНИЗМОВ КАК ОБЪЕКТА ИЗУЧЕНИЯ МОЛЕКУЛЯРНОЙ ГЕНЕТИКИ
При выделении микроорганизмов, в отличие от растений и животных, был использован совершенно другой критерий — величина особи. Поэтому сюда отнесены такие сложноорганизо-ванные существа, как водоросли и грибы, имеющие истинные ядра и типичные для высших организмов хромосомы, с одной стороны, и вирусы и фаги — с другой. Последние представляют собой неклеточные формы, паразитирующие на бактериях (бактериофаги), растениях и животных (вирусы). Роль хромосомы у них играет молекула ДНК или РНК. Промежуточное положение занимают бактерии. Бактерии более сложно организованы, чем вирусы, но ядро их не отделено от цитоплазмы, а функцию хромосомы также выполняют нити ДНК- Деление клетки осуществляется без образования веретена. Величина микроорганизмов варьирует в широких пределах: от 10 ммк до нескольких десятков микрон.
Однако микроорганизмы имеют общие особенности, которые и сделали их основным объектом молекулярной генетики. Основной особенностью является короткий жизненный цикл. Так, например, многие бактериофаги, вирусы и бактерии заканчивают жизненный цикл в течение 20—30 минут, грибы за 1—2 часа, а водоросль хлорелла за 1 сутки. Эта их особенность обеспечивает возможность получения огромного числа поколений в короткие сроки. Другая особенность микроорганизмов — большая скорость размножения — обеспечивает получение огромного количества особей одновременно, что дает возможность обнаруживать такие генетические явления, которые встречаются с частотой один на миллион и реже. Третья особенность — наличие у многих микроорганизмов двух способов размножения (бесполого и полового). Это создает возможность получения рекомбинаций в ходе полового размножения и изучения продуктов рекомбинаций непосредственно после мейоза в гаплофазе при бесполом размножении.
|
|
|
Все это несравненно увеличивает разрешающую способность генетического анализа.
Своеобразной заменой полового процесса у фагов и вирусов является способность их проникать в клетку хозяина по нескольку частиц сразу. Во время совместного размножения этих частиц и происходит процесс рекомбинации их генетического материала.'
На рисунке 108 видно, что после совместного заражения двумя фагами бактерий Escherichia coli В. (кишечная палочка) появляются такие формы, которые сочетают признаки (характер лизиса) двух исходных.
|
|
|
Кроме того, микроорганизмы легко выращивать в строго контролируемых условиях, используя жидкие или твердые среды определенного состава, регулируя температуру и т. д.
При изучении генетики микроорганизмов 'исследователи столкнулись с большой трудностью в диагностике признаков отдельных особей. Однако выход был найден и дал прекрасные результаты: оценке подвергаются признаки клонов, штаммов, колоний.
Признаки делятся на несколько групп. Морфологические . признаки связаны с формой или размером колоний, характером ее поверхности и т. д. Оцениваются они, как правило, визуально.
Биохимические признаки связаны с изменением в синтезе тех или иных веществ. Они изучаются наиболее легко у микроорганизмов благодаря использованию метода селективных сред. Сущность этого метода состоит в следующем. Организмы дикого типа — прототрофы — способны жить и размножаться на среде, содержащей минеральные соли и углеводы, из которых они синтезируют все необходимые для своей жизни вещества. Такая среда называется минимальной. В отличие от прото-трофов ауксотрофы — организмы, утерявшие способность к синтезу тех или иных веществ, не способны жить на минимальной среде. Они могут расти на полной среде, т. е. среде, содержащей все необходимые для жизни клетки метаболиты. Для того чтобы точно определить, какая именно биохимическая мутация характеризует тот или иной клон ауксотрофов, необходимо использовать селективную среду, т. е. среду, которая отличается от полной отсутствием того или иного метаболита (витамина, аминокислоты или азотистого основания), а от минимальной — наличием этого вещества. Например, если анализируемый клон живет на селективной среде, представляющей собой минимальную среду с добавкой только аминокислот, это значит, что он является ауксотрофом по аминокислотам, т. е. он не способен синтезировать какую-то аминокислоту. Какую именно, легко определить, используя селективные среды с содержанием отдельных аминокислот.
|
|
|
258
259

1 |
|
|
a
4 P"
§ 0
Ч -/
6
Ч _/
О о
| б |
в
109. Частота возникновения ауксотро-
| Метод отпечатков для выделения биохимических мутаций у микроорганизмов: / — чашка с анализируемыми
в — азотистых оснований. |
фов невелика, поэтому для ускорения работы используют дополнительно метод отпечатков. Для облегчения пересева колоний применяют специальную бархатную печатку, имеющую размер и форму чашки Петри. Сначала к печатке прикладывают чашку с анализируемыми колониями, выросшими на полной среде. На ворсинках бархата остаются клетки отдельных колоний. Затем к этой печатке прикладывают две чашки— с минимальной и полной средой. После инкубации таких отпечатков сопоставляют колонии, выросшие на полной и на минимальной среде. Практически это делают таким образом: чашку с минимальной средой ставят на чашку с полной средой так, чтобы идентичные колонии совпали. Просматривая две совмещенные чашки в проходящем свете, на чашке с полной средой отмечают колонии, которые не выросли на минимальной среде. Это дает возможность обнаружить мутантные колонии (рис. 109).
Далее из мутантной колонии, выросшей на полной среде, делают отсев на селективные среды, содержащие только аминокислоты, или только витамины, или только основания нуклеиновых кислот. Колонии, выросшие на одной из этих трех сред,
относятся к мутантам, нуждающимся именно в этом типе метаболитов. В дальнейшем проводят испытания на потребность в отдельном метаболите — определенной аминокислоте, витамине и т. д.
Существуют также специальные методы концентрирования биохимических мутантов с целью уменьшения затрат времени и труда на их выявление. Сущность одного из них заключается в том, что к суспензии клеток в жидкой минимальной среде прибавляют антибиотик пенициллин. Установлено, что пенициллин поражает только делящиеся клетки. Так как в минимальной среде размножаются клетки только дикого типа, то они в основном и поражаются. Не размножающиеся на минимальной среде биохимические мутанты не поражаются. Затем клетки отмывают от пенициллина и высевают на полную среду в чашки Петри. Так как большая часть клеток дикого типа была убита пенициллином, то среди вырастающих колоний на полной среде относительное количество колоний биохимических мутантов оказывается увеличенным.
С выросших колоний делают отпечатки на минимальную среду и выделяют мутанты.
Нужно заметить, что сам принцип селективных сред не является для генетики и селекции новым. Принцип селективных сред базируется на методе отбора мутантов на провокационном фоне, которым издавна пользовались селекционеры. Например, И. В. Мичурин широко применял отбор сеянцев плодовых растений на провокационном фоне и называл это спартанским воспитанием сеянцев. Обычно этим методом пользуются при отборе растений, устойчивых к различным заболеваниям, морозоустойчивых и т. д. В генетических работах с микроорганизмами принцип отбора на провокационном фоне получил блестящее развитие благодаря использованию метода отпечатков.
Третья группа признаков относится к устойчивости — чувствительности микроорганизмов по отношению к факторам абиотическим (температура, свет, химические вещества и др.) и биотическим (фаги, вирусы и т. д.). Для изучения этих признаков также часто используется метод селективных сред. Так, для проверки устойчивости к антибиотику его добавляют в среду. Устойчивые микроорганизмы выживают, чувствительные — гибнут.
Однако при этом может возникнуть сомнение, действительно ли на селективных средах выявляются уже существовавшие мутации. Быть может, вырастающие колонии приобретают устойчивость вследствие прямой адаптации части клеток к антибиотику, добавленному в питательную среду. Решить этот вопрос позволяет тот же метод отпечатков (рис. ПО). Например, если вырастить культуру бактерий в чашке со средой без антибиотика, а затем сделать с такого посева ряд отпечатков на
260
261
 чашки с селективной средой, содержащей антибиотик, то на каждой чашке вырастут единичные колонии, устойчивые к антибиотику. При этом расположение колоний оказывается идентичным на всех чашках. Если из соответствующих этим колониям мест исходной культуры взять клетки для испытания на среде с антибиотиком, то они оказываются устойчивыми к нему. Следовательно, они обладали этим свойством еще до контакта с антибиотиком. Значит, это свойство имеет преадаптивную
чашки с селективной средой, содержащей антибиотик, то на каждой чашке вырастут единичные колонии, устойчивые к антибиотику. При этом расположение колоний оказывается идентичным на всех чашках. Если из соответствующих этим колониям мест исходной культуры взять клетки для испытания на среде с антибиотиком, то они оказываются устойчивыми к нему. Следовательно, они обладали этим свойством еще до контакта с антибиотиком. Значит, это свойство имеет преадаптивную
|
|
110.
Метод отпечатков, демонстрирующий преадаптивную природу мутаций:
/ — отпечаток с колоний, выросших иа среде без стрептомицина; 2 — отпечатки на среду со стрептомицином; высев колоний: 3 — чувствительной и 4 — устойчивой на среду со стрептомицином.
природу и селективная среда лишь выявила уже имевшиеся в популяции устойчивые мутантные клетки.
У бактериофагов и вирусов в качестве признаков часто используются свойства негативной колонии (стерильного пятна или пятна лизиса) или места поражения и поражаемый хозяин.
Негативной колонией называют светлое пятно (обнаженный агар) на поверхности равномерно размножившегося хозяина — бактерий в чашке Петри на питательной среде. Светлое пятно получается, как правило, за счет лизиса бактерий, вызванного размножившейся единичной частицей фага. Следовательно, форма и размер негативной колонии определяются свойствами фага, а потому и служат характеризующим его признаком (см. рис. 108). Таким же образом форма и размер некротических пятен на листе табака служит, например, характеристикой вируса табачной мозаики.
В отношении второй группы признаков (пораженный хозяин) можно привести такой пример: мутант г II фага Г4 не поражает бактерии Escherichia eoli штамма К, что и служит его характеристикой.
Обозначение признаков у микроорганизмов несколько отличается от системы, принятой для растений и животных. Здесь признаки обозначают первыми буквами их названия, с пометкой знаком « + » доминантных и знаком «—» рецессивных признаков, например: гладкая колония у дрожжей обозначается rgh^, а морщинистая — rgh~; ауксотроф по аденину — ad~, так как он рецессивен по отношению к прототрофу ad+, ауксотроф по триптофану — Т~, а прототроф — Т+ и т. д.
После краткого знакомства с особенностями микроорганизмов вернемся к основному вопросу: какова же химическая природа единицы наследственности — гена? На основании данных, которые были изложены в разделе I, возможны два предположения: наследственную информацию несет или белок, или ДНК, так как именно эти два компонента составляют основу хромосом и других самовоспроизводящихся структур клетки.
Первая гипотеза относительно материальных основ наследственности называлась белковой гипотезой. Она отводила исключительную роль в хранении наследственной информации белку, так как белковые молекулы обладают специфичностью. Но теперь эта гипотеза оставлена под влиянием многочисленных фактов, говорящих в пользу второй гипотезы, которая главенствующую роль отводит ДНК.
2. ДНК— НОСИТЕЛЬ НАСЛЕДСТВЕННОЙ ИНФОРМАЦИИ
Косвенные доказательства, что ДНК — носитель наследственной информации. Гипотеза о том, что ДНК — носитель наследственной информации, появилась сравнительно недавно и причиной этого является однотипность в строении ДНК всех организмов (см. гл. 2).
Однако постепенно накапливались факты, которые говорили о том, что наряду с однотипностью существует видовая специфичность в распределении и в количественном соотношении пуриновых и пиримидиновых оснований в молекулах ДНК.
Анализ количества ДНК в клетках показал, что оно относительно константно, независимо от дифференцировки и состояния клетки, а в диплоидных клетках вдвое большее, чем в гаплоидных, в отличие от всех других компонентов.
Как уже было сказано (см. гл. 13), при облучении клеток ультрафиолетовыми лучами мутагенное действие оказывают лучи именно той длины волны, которые интенсивно поглощаются ДНК, отсюда можно предположить, что мутации связаны
262
263
| .'• лВыделениеЛНК I Среда со стрептомицином |
с изменением ДНК. Включение в ДНК аналогов пуриновых и миримидиновых оснований также сопровождается высоким мутагенным действием.
Однако это были лишь косвенные доказательства в пользу высказанной гипотезы. Прямые доказательства были получены при изучении микроорганизмов.
Трансформация. Открытие явления трансформации у бактерий было сделано в 1928 г. Сущность его состоит в следующем. Известны два штамма пневмококка — Diplococcus pneumoniae: вирулентный штамм S — с полисахаридной капсулой и гладкими колониями и невирулентный штамм R— без капсулы и с шероховатыми колониями. Ф. Гриффит инъецировал мышам вместе с убитым нагреванием штаммом пневмококка, обладающим капсулой (S), штамм живого пневмококка, лишенного капсулы (R). Спустя некоторое время ему удалось выделить из зараженных мышей живых пневмококков, обладающих капсулой. Таким образом, оказалось, что свойство убитого пневмококка— способность образовывать капсулу — перешло к живой бактерии. Поскольку признак наличия капсулы является наследственным, то следовало предположить, что какая-то часть наследственной информации от бактерий штамма S перешла в клетки штамма R. Но как это могло произойти, если клетки штамма S были убиты? Можно было предполагать, что в этом случае либо возникла мутация, либо произошла своеобразная гибридизация между живыми и мертвыми бактериями. Первое объяснение было наиболее вероятным, однако, вопреки здравому смыслу, второе объяснение оказалось ближе к истине.
В 1944 г. О. Эвери с сотрудниками удалось выяснить природу этого загадочного явления. Они взяли те же два штамма — R и S. Перед началом решающих опытов было изучено спонтанное мутирование обеих форм. Оказалось, что гладкая S-форма хотя и очень редко, но спонтанно мутирует в 7?-форму, а 7?-форма практически вовсе не мутирует в S-форму, т. е. мутации происходят почти исключительно в одном направлении: S->R. Но если /?-форму помещали в экстракт из убитых клеток S-формы, то частота изменения R-+S увеличивалась в 10 000 раз. Стало очевидным, что признак одного штамма (S) через какое-то вещество экстракта передавался другому штамму (R). Возникало наследственное изменение, которое способно было сохраняться в ряду поколений. Далее была произведена тщательная очистка — выделение этого вещества из экстракта клеток S-формы. Вещество было названо трансформирующим фактором, а само явление — трансформацией. Трансформирующий агент по своей биохимической природе представлял собой не что иное, как ДНК.
Явление трансформации стало одним из основных доказательств роли ДНК как носителя наследственной информации.
 В последующих генетических и биохимических исследованиях было показано, что явление трансформации широко распространено у бактерий.
В последующих генетических и биохимических исследованиях было показано, что явление трансформации широко распространено у бактерий.
На рисунке 111 приведена схема опыта, доказывающая наличие трансформации.
| Среда со стрептомицином |
| 111. Схема опыта, демонстрирующего явление трансформации: штаммы бактерий Sm — чувствительный к стрептомицину; Sm — устойчивый к стрептомицину. |
 Устойчивость к стрептоми
Устойчивость к стрептоми
цину была передана от штам
ма Smr к Stns с частью
молекулы ДНК, где «записа
на» наследственная информа
ция стрептомициноустойчиво-
сти. Если же ДНК донора пе
ред помещением в культуру
реципиента обработать разру
шающим ее ферментом дезок-
сирибонуклеазой, то трансфор
мации не происходит. Актив
ность трансформирующего
агента оказалась чрезвычайно
высокой. Так, трансформация
осуществляется в течение 15
минут при концентрации ДНК
0,00015 y (y=10~6 г) в I мл
среды.
Как правило, трансформируются различные признаки, но не более одного и лишь иногда одновременно несколько сцепленных признаков. Обычно трансформация возможна между различными штаммами одного и того же вида, однако недавно была показана возможность межвидовой трансформации.
При изучении действия мутагенов на ДНК, обладающую трансформирующей активностью, обнаружена различная чувствительность к мутагенам отдельных наследственных факторов этого трансформирующего агента. Так, например, облучение ультрафиолетом значительно чаще инактивирует фактор, определяющий форму капсулы у пневмококков, чем фактор, обусловливающий устойчивость к стрептомицину.
Механизм трансформации еще недостаточно изучен. Предполагают, что при трансформации происходит рекомбинация между молекулами ДНК.
Убедительных фактов трансформации у высших организмов пока неизвестно. Впрочем, в принципе осуществление трансформации на соматических клетках животных и человека вполне
264
265
возможно. Так, показано, что клетки в культуре тканей могут усваивать, включать меченую ДНК из среды. Возможно, метод культуры тканей откроет новые перспективы исследований в этой области.
Трансдукция. Кроме явления трансформации на бактериях было открыто еще одно интересное явление — трансдукция. Но прежде чем рассказать об этом явлении, необходимо напомнить о взаимоотношениях бактериофага и бактерии. Фаги поражают определенный для каждого из них вид и даже определенные штаммы бактерий. Фаги имеют характерную форму и размеры. Так, фаги серии Т кишечной палочки состоят из головки и хвоста. Размер частиц фагов колеблется от 20 до 500 ммк. Фаг состоит из белковой оболочки и внутреннего содержимого—ДНК. Нуклеиновая кислота находится в головной части фага. Конец хвоста фага морфологически довольно сложен. С его помощью фаг прикрепляется к поверхности поражаемой клетки. На кончике хвоста фага имеется фермент лизоцим. Вслед за прикреплением к бактериальной клетке фаг с помощью лизоцима локально разрушает (лизирует) оболочку, и содержащаяся в нем ДНК впрыскивается внутрь клетки. Так осуществляется заражение клетки. При этом белковая оболочка фага остается на поверхности клетки, а внутрь ее проникает, по-видимому, лишь ДНК фага. Внутри бактерии ДНК фага начинает воспроизводиться, реплицироваться, используя ферментные системы и материалы клетки-хозяина. Затем ДНК фага окружается специфическим белком, в результате чего образуются зрелые частицы фага. Через 10—45 минут после заражения бактериальная клетка лизируется и из нее в среду выходят зрелые частицы фага (от 100 до 300), которые способны вновь заражать здоровые бактерии.
Сущность явления трансдукции и способ его открытия состоят в следующем, ^/-образная трубка в нижней части была разделена бактериальным фильтром. В одну половину этой трубки были помещены бактерии мышиного тифа (Salmonella typhimurium) штамма 22Л, а в другую половину трубки — штамма 2А, лизогенного по фагу (рис. 112). При этом бактериальные клетки не могли переходить сквозь перегородку. Штамм 22А нес мутацию, тормозящую синтез триптофана Т ~, чи поэтому при культивировании бактерии нуждались в добавке триптофана в среду. Штамм бактерии 2Л синтезировал триптофан (Т+), а поэтому не нуждался в нем при культивировании.
После инкубации этих двух штаммов в трубке, разделенной только бактериальным фильтром, был произведен рассев клеток обоих штаммов. При рассеве клеток штамма 22Л на среде, лишенной триптофана, было обнаружено небольшое число колоний. Следовательно, некоторые клетки штамма 22Л каким-то
266
образом приобрели способность синтезировать триптофан и смогли дать колонии на среде без этой аминокислоты. Частота появления таких клеток была равна IX Ю-5.
Можно было предположить, что эти измененные клетки появились или в результате обратной мутации от Т~ к Г+, или в результате перехода трансформирующего фактора от штамма 2А. Но штамм 22Л отличался высокой стабильностью, и поэтому указанную частоту появления (10~5) клеток генотипа Т+ нельзя было объяснить возникновением обратных мутаций. Трансформирующий фактор в среде также не был обнаружен. Следовательно, перенос мог произойти только с помощью фага из штамма 2А. Фаг, вышедший из бактериальных клеток штамма 2А, проник через фильтр, внедрился в некоторые клетки штамма 22Л и передал им часть наследственной информации — фрагмент наследственного материала штамма 2А. Явление переноса бактериофагом наследственной информации от одних бактерий к другим — новая форма рекомбинации генов — получило название трансдукции. Первые факты, доказавшие существование трансдукции, были получены в 1952 г. Механизм этого явления окончательно еще не разгадан. Несомненно, что трансдукция возможна лишь при условии, если ДНК фага взаимодействует с ДНК бактериальных клеток.
Фаг может переносить самые различные гены бактерий. Как правило, одновременно трансдуцируется один, реже два тесно сцепленных гена и очень редко три гена.
 Таким образом, явле
Таким образом, явле
ние трансдукции так же,
как и трансформации,
является убедительным
доказательством в поль
зу того, что ДНК являет
ся носителем наследствен
ной информации. , _ „_,- .
Бактериальные клетки
ГенТ +
112.
| Лизированная клетка |
Схема опыта, демонстрирующего явление трансдукции у Salmonella.
| бактериофаг |
| Фильтр |
Штаммы бактерий 22А — не способных синтезировать триптофан (7"-); 2А — способных синтезировать триптофан (Г*) и лизогенных по бактериофагу.
267
| ские» клетки F~ очень редко приобретают свойства Hfr. Генетический о г ^ ч, с /(. n,ngiuicumn Зависимость передачи гене- ЯиЯПТЛО ПЛ1/ПППВ ».~л — -------------------- ' тического материала от продолжительности конъюгации у Escherichia coli (2) и передача эписом на примере ^-фактора (/). F+ — «мужские» клетки; F~ — «женские» клетки; Hfr — половой тип, определяющий высокую частоту рекомбинаций; В, L, Т — символы генов; О — участок хромосомы, с которого начинается ее передача от реципиента к донору. |
| 114. |
ЭПИСОМЫ
Не менее интересные данные были получены при изучении характера наследования признаков у бактерий. Генетическим и цитологическим (электронная микроскопия) методами было показано, что у бактерий Escherichia coli перенос генетической информации от одной бактерии к другой осуществляется в процессе контакта клеток, получившего название конъюгации (рис. 113). При этом передача осуществляется лишь односторонняя. Единственная хромосома бактериальной клетки имеет форму замкнутого кольца, которое рвется лишь во время конъюгации и переходит из одной клетки в другую.
Напомним, что роль хромосомы здесь выполняет двунитча-тая ДНК длиной 1,2—1,4 ммк. Количество переданного хромосомного материала зависит от длительности конъюгации, но, как правило, это бывает лишь небольшая часть исходной хромосомы. Таким образом, в результате конъюгации образуется одна клетка, которая имеет свою целую хромосому плюс фрагмент другой. Такая клетка получила название мерозиготы, в ней и происходит процесс рекомбинации, который легко анализируется генетически. Другая клетка, передающая хромосому, сохраняется без изменений, так как во время конъюгации происходит репродукция ДНК.
Изучение ряда штаммов кишечной палочки показало, что между некоторыми из них не происходит конъюгации, а между другими она идет успешно с возникновением рекомбинантных форм. Это позволило разделить все штаммы на две группы и рассматривать их как половые типы. Обозначаются они 77+ или F-. Сравнение показало, что поведение бактерий разных половых типов в скрещивании функционально различно. Среди клеток F~ после конъюгации появляются мерозиготы и рекомби-нанты с частотой 1 на Ю-6 или Ю-9 клеток. Поэтому клетки F~ называют «женскими». Клетка F+ выступает в роли оплодотворяющей («мужской»), она в процессе конъюгации передает ДНК, несущую наследственную информацию.
Было замечено, что после конъюгации очень многие клетки F~ приобретают характеристику F+, не получая каких-либо других признаков этой культуры. Передача полового фактора происходит как бы независимо от других генетических маркеров (рис. 114,./). В ряде экспериментов было доказано, что половой фактор F+ является нехромосомным, он состоит из ДНК и содержит около 103 пар нуклеотидов.
Позже среди других штаммов кишечной палочки был выявлен и третий половой тип, определяющий высокую частоту рекомбинаций и обозначенный Hfr. Скрещивания F~XHfr дают особенно высокий процент рекомбинантов: 1 на 10 исходных клеток. Вместе с тем, в отличие от скрещиваний с F+, «жен-
'268
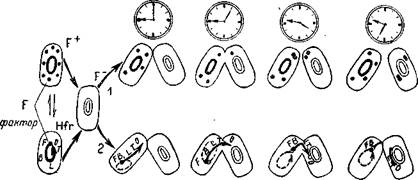
анализ показал, что в данном случае половой фактор передается сцепленно с другими генами и занимает определенный локус в бактериальной хромосоме. Он всегда оказывается последним при переходе хромосомы в клетку F~ (рис. 114, 2).
У. Хэйс показал, что штаммы Hfr происходят от штаммов F+ и что это изменение не связано с утратой фактора, так как при обратном мутировании Hfr-+F+ свойство донорства полового фактора восстанавливается. Таким образом, если ^-фактор присутствует в клетке, он может вести себя двояко: как цитоплазматическая частица (в клетках F+) или как локус хромосомы (в клетках Hfr) .
У бактерий было обнаружено еще несколько генетических детерминантов, ведущих себя подобно F-фактору и способных находиться в клетке в двух альтернативных состояниях — в виде цитоплазматической частицы или в виде локуса бактериальной хромосомы. Такие детерминанты названы эписомами.
Представляет интерес эписома, которая была обнаружена у кишечных бактерий и названа RTF. Она обусловливает множественную устойчивость клеток к антибиотикам (по крайней мере к четырем). Передается RTF при конъюгации в течение одной минуты, независимо от передачи хромосомной ДНК, причем может передаваться от патогенных видов к клеткам кишечной палочки, которые постоянно обитают в кишечнике, и наоборот. Эта особенность эписомы RTF имеет большое значение для эпидемиологии. В Японии, где была изучена эта эписома, наблюдалось интересное явление: после введения антибиотиков
269
в терапию дизентерийных заболеваний число их резко сократилось, а потом вновь кривая заболеваемости пошла вверх. Частота встречаемости штаммов бактерий с множественной устойчивостью в это же время увеличилась более чем в 400 раз.
Дата добавления: 2020-01-07; просмотров: 435; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!


