Электролиз раствора сульфата меди с растворимым
(медным) анодом
Присоедините графитовый электрод к отрицательному полюсу выпрямителя. Этот электрод является катодом. В качестве анода используйте омедненный угольный электрод предыдущего опыта. Присоедините его к положительному полюсу выпрямителя. Пропускайте ток в течение 8-10 минут. Что при этом наблюдается? Какие процессы протекают у анода и катода? Напишите уравнения реакций.
Контрольные вопросы
1. Что называется электролизом?
2. Сформулируйте 3 правила катодного восстановления и 2 правила анодного окисления электролиза с нерастворимыми электродами.
3. В чем отличие процессов электролиза с нерастворимыми и растворимыми электродами?
4. Составьте схемы электролиза с нерастворимыми электродами водных растворов следующих солей: NaNO2, Na2S, Ni(NO3)2, СоСl2, HgCl2, АgNO3.
5. В какой последовательности будут выделятся на катоде металлы при электролизе раствора, содержащего ионы Fe2+, Ni2+ и Сu2+?
6. Сущность и применение электролиза расплавов солей активных металлов.
Лабораторная работа № 12
КОРРОЗИЯ МЕТАЛЛОВ
Теоретическая часть
Коррозией называется химическое или электрохимическое разрушение металлов и сплавов в результате их взаимодействия с окружающей средой. Коррозионными процессами являются ржавление железа на воздухе, разрушение подводных и подземных металлических конструкций и коммуникаций, разъедание металлов кислотами и т.д.
|
|
|
Коррозия протекает самопроизвольно, т.к. энергия, затраченная на получение металлов из природных соединений, накапливается в них как свободная энергия Гиббса (DG). Свободная энергия Гиббса делает металлы химически активными веществами, переходящими в результате взаимодействия с окружающей средой в состояние положительно заряженных ионов:
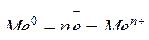 , (коррозионный процесс), DG<0.
, (коррозионный процесс), DG<0.
В основе коррозионного разрушения металлов лежат сложные физико-химические процессы, протекающие на границе металла с внешней средой.
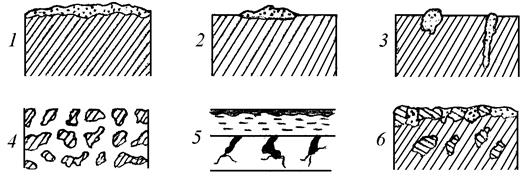
По характеру коррозионных разрушений металлов различают следующие виды коррозии: 1) равномерная, 2) пятнистая, 3) точечная, 4) межкристаллитная, 5) растрескивающая, 6) селективная (рис.1).
|
Рис.1. Виды коррозии
По механизму протекания различают два основных типа коррозии: 1) химическую, 2) электрохимическую.
Химическая коррозия
Химическая коррозия протекает в средах, не проводящих электрический ток, и может быть газовой или жидкостной. Химическая газовая коррозия вызывается действием на металл сухих газов: О2, Н2, Cl2, Н2S, SО2, СО2 и т.д. Она протекает на сухой поверхности металла и особенно интенсивно при повышенной температуре. Химической газовой коррозии подвергаются электронагревательные устройства, лопасти турбин, котельные установки, арматура топок, печей и т.д. Скорость коррозии зависит от температуры и состава газовой среды, состояния поверхности металла (пыльная и шероховатая поверхность разрушается интенсивнее) и др. Например, газовая коррозия углеродистой стали при 300-600 0С сопровождается образованием пористого слоя окалины, состоящей из оксидов FeO, Fe2O3 и Fe3O4, которая не препятствует дальнейшему протеканию коррозии. В этом случае возможно протекание реакции обезуглероживания стали:
|
|
|
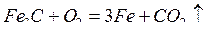 , что приводит к потере прочности. Химической газовой коррозии в меньшей степени подвергаются алюминий, титан и хром, т.к. на поверхности этих металлов имеются очень плотные и эластичные оксидные пленки. Разрушение этих пленок может быть вызвано действием агрессивных ионов с очень малым радиусом, например, Сl¯.
, что приводит к потере прочности. Химической газовой коррозии в меньшей степени подвергаются алюминий, титан и хром, т.к. на поверхности этих металлов имеются очень плотные и эластичные оксидные пленки. Разрушение этих пленок может быть вызвано действием агрессивных ионов с очень малым радиусом, например, Сl¯.
Химическая жидкостная коррозия металлов протекает в жидких неэлектролитах: бензоле, толуоле, четыреххлористом углероде, жидких топливах (мазут, керосин, бензин, нефть) и т.д. Коррозия в неэлектролитах сводится к химической реакции металла с активным компонентом. Известно, например, что в нефти и продуктах ее перегонки содержится до 5% серы и ее соединений, активно взаимодействующих с металлами. Так, при химической жидкостной коррозии стали коррозионное разрушение может быть вызвано сероводородом по уравнению:
|
|
|

Электрохимическая коррозия
Электрохимическая коррозия металлов протекает в средах, проводящих электрический ток. Большинство коррозионных процессов носит электрохимический характер, например, коррозия металлов в атмосферных условиях, коррозия металлических конструкций, находящихся в земле, грунтовых водах, морской воде и т.д.
Основные условия возникновения электрохимической коррозии:
1) химическая неоднородность металла,
2) контакт различных металлов,
3) различный доступ кислорода к поверхности металла или сплава,
4) наличие неоднородных оксидных пленок, смазки и пыли на поверхности детали,
5) различные температуры, скорости движения электролита у поверхности металла.
Различают следующие виды электрохимической коррозии:
1) гальванокоррозия;
2) электрокоррозия.
Гальванокоррозия
Гальванокоррозия возникает не только при контакте двух различных металлов в среде электролита (макрокоррозия), но и на различных участках одного и того же металла при наличии примесей (микрокоррозия). Согласно теории электрохимической коррозии, при соприкосновении двух металлов с раствором электролита или одного металла с примесями, на поверхности возникает макрогальванический элемент (макрогальванопара) или, соответственно множество микрогальванических элементов (микрогальванопар).
|
|
|
Металл или участки металла с более отрицательными значениями электродных потенциалов окажутся анодами и будут окисляться:
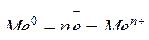 ,
,
а на металлах (участках металла) с более положительными значениями электродных потенциалов, будет происходить восстановление окислителя из окружающей среды.
Рассмотрим механизм электрохимической коррозии на примере контактной коррозии, возникающей в результате соприкосновения цинка и меди в растворе НСl. При таком контакте возникает гальванический элемент (гальванопара):
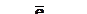
А(-)Zn/НСl/Cu(+)К,
в котором анодом является цинк, т.к. его стандартный электродный потенциал равен - 0,76 В, а Сu + 0,34 В. На аноде происходит процесс окисления:
 ,
,
и цинк растворяется. Катодом является медь. На катоде в кислой среде происходит процесс восстановления ионов водорода:
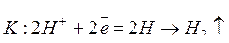 (коррозия с водородной деполяризацией).
(коррозия с водородной деполяризацией).
В нейтральной и щелочной средах на катоде протекает процесс восстановления кислорода, растворенного в воде:
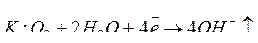 (коррозия с кислородной деполяризацией).
(коррозия с кислородной деполяризацией).
Коррозия с кислородной деполяризацией ¾ самый распространенный случай коррозии (в грунте, в атмосфере, в нейтральных солевых средах и т.д.).
Электрокоррозия
Электрокоррозия — это электрохимическая коррозия, возникающая под действием блуждающих токов. Источниками блуждающих токов могут быть все источники постоянного тока и все потребители (рельсовые пути трамвайных линий, силовые шины в электролизных цехах и т.д.) вследствие недостаточной их изоляции. Участки входа блуждающего тока в подземное сооружение (катоды) не разрушаются, на них происходит процесс восстановления растворенного в воде кислорода:
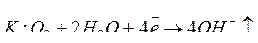
В местах выхода блуждающего тока (анодах) подземное сооружение разрушается:
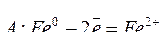 .
.
Экспериментальная часть
Цель работы: ознакомиться с процессами, происходящими при электрохимической коррозии.
Опыт № 1
Дата добавления: 2019-09-13; просмотров: 497; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!