Число электронов, отдаваемых восстановителем, должно быть равно числу электронов, присоединяемых окислителем.
Классификация окислительно-восстановительных реакций
Все ОВР делятся на три группы:
1. Реакции межатомного и межмолекулярного окисления- восстановления. В этих реакциях обмен электронами происходит между различными атомами и молекулами:
 ,
,
 .
.
2. Реакции внутримолекулярного взаимодействия, когда и окислитель, и восстановитель находятся в одной молекуле:
 .
.
3. Реакции самоокисления-самовосстановления (диспропорционирования), когда атомы одного и того же элемента внутри данной молекулы взаимно окисляют и восстанавливают друг друга:
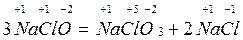 .
.
Методы составления уравнений окислительно-восстановительных реакций
Для составления уравнений химических реакций необходимо знать формулы исходных и получающихся в результате реакций веществ. Продукты реакции устанавливаются либо экспериментально, либо на основании известных свойств элементов. В исходных веществах и продуктах реакции должно быть одинаковое число одних и тех же атомов (закон сохранения массы вещества).
Для составления уравнений ОВР обычно пользуются методом электронного баланса.
Метод электронного баланса
Этот метод заключается в определении степеней окисления атомов, подвергающихся окислению и восстановлению, с последующим сведением электронного баланса, например, в реакции:
 ,
,
окисление серы сопровождается отдачей четырех электронов и присоединением их к кислороду. Этот процесс перераспределения электронов может быть выражен электронными уравнениями:
|
|
|
 — процесс окисления,
— процесс окисления,
 — процесс восстановления.
— процесс восстановления.
При окислении-восстановлении должен соблюдаться баланс отданных и присоединенных электронов. Для сбалансирования отданных и присоединенных электронов справа (или слева) от электронного уравнения проставляют множители, являющиеся основными коэффициентами уравнения:


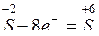 2 1 окисление, восстановитель
2 1 окисление, восстановитель
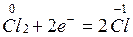 8 4 восстановление, окислитель
8 4 восстановление, окислитель

 .
.
Экспериментальная часть
Цель работы: на конкретных лабораторных опытах ознакомиться с ОВР и научиться расставлять коэффициенты в уравнениях методом электронного баланса.
Опыт № 1
Окислительные свойства перманганата калия КМnО4
Налейте в три пробирки по 1 капле раствора перманганата калия. Добавьте в одну из них 3-4 капли раствора серной кислоты, в другую столько же дистиллированной воды, а в третью столько же раствора гидроксида калия. Затем внесите во все три пробирки по 2-3 микрошпателя сульфита натрия. Наблюдайте обесцвечивание раствора перманганата калия в первой пробирке, выпадение бурого осадка во второй и позеленение раствора в третьей. Объясните наблюдаемые явления.
|
|
|
 ,
,
 ,
,
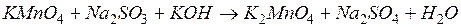 .
.
Расставьте коэффициенты в уравнениях, используя метод электронного баланса. Отметьте, как влияет реакция среды на восстановление перманганата калия.
Опыт № 2
Окислительные свойства дихромата калия К2Cr2О7
Внесите в пробирку 5-6 капель раствора дихромата калия, добавьте 2-3 капли раствора серной кислоты и 2-3 микрошпателя сульфата железа (II). Объясните переход оранжевой окраски раствора в зеленую.
 .
.
Расставьте коэффициенты в уравнении, используя метод электронного баланса.
Опыт № 3
Окислительно-восстановительные свойства солей азотистой кислоты НNО2
а) внесите в пробирку 5-6 капель водного раствора йодида калия, добавьте 2-3 капли раствора серной кислоты и 2-3 капли нитрита натрия. Наблюдайте выделение свободного йода и пузырьков газа.
 ;
;
б) внесите в пробирку 1 капле водного раствора перманганата калия, добавьте 2-3 капли раствора серной кислоты и 2-3 капли нитрита натрия. Наблюдайте обесцвечивание раствора.
 .
.
Расставьте коэффициенты в уравнениях, используя метод электронного баланса.
Контрольные вопросы
1. Какие реакции называются окислительно-восстановительными?
2. Что такое степень окисления атома?
3. Укажите степени окисления атомов в молекулах:
|
|
|
 .
.
4. Напишите электронные уравнения, укажите окислитель и восстановитель, расставьте коэффициенты по методу электронного баланса:
 ,
,
 .
.
5. Назовите типичные окислители и восстановители.
6. Назовите основные типы ОВР.
Лабораторная работа № 10
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
Теоретическая часть
Химические процессы, сопровождающиеся появлением электрического тока или вызываемые подведенной извне электрической энергией, называются электрохимическими.
Гальванический элемент — это система, в которой химическая энергия окислительно-восстановительных процессов превращается в электрическую энергию, т.е. протекание химических процессов вызывает появление электрического тока.
Причиной возникновения и протекания электрического тока в гальваническом элементе является разность электродных потенциалов.
 Как известно, кристалл любого металла можно представить как равновесную систему, состоящую из атомов, ионов и электронов (рис.1).
Как известно, кристалл любого металла можно представить как равновесную систему, состоящую из атомов, ионов и электронов (рис.1).

Рис. 1. Схема кристалла металла
Если металл привести в контакт с водой, то полярные молекулы воды вступят во взаимодействие с катионами поверхностного слоя металла. В результате катионы будут отторгнуты от кристаллической решетки металла и перейдут в раствор в гидратированном состоянии (рис. 2). В массе металла при этом будут оставаться электроны, которые создают в пограничном с жидкостью слое металла отрицательный электрический заряд.
|
|
|


Рис. 2. Взаимодействие металла с водой
Перешедшие в раствор ионы Меn+ в непосредственной близости к его поверхности создают положительный электрический заряд. В результате образуется двойной электрический слой, имеющий диффузионное строение (рис. 3).
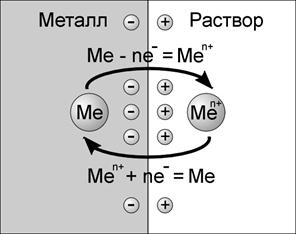
Рис. 3. Двойной электрический слой
Способность посылать ионы в раствор различна у различных металлов. Она зависит от количества энергии, необходимой для отрыва иона от кристаллической решетки металла, и количества энергии, выделяющейся при гидратации иона.
Отрицательные и положительные заряды на границе металл-жидкость обусловливают возникновение в пограничной области разности потенциалов, которую называют электродным потенциалом металла.
По мере перехода ионов в водную среду увеличивается отрицательный заряд металла и положительный заряд раствора, поэтому у поверхности металла все чаще и чаще катионы металла притягиваются обратно на металлическую пластину. Быстро наступающее равновесие можно изобразить следующей схемой:
 (1)
(1)
где  — атом металла в кристаллической решетке;
— атом металла в кристаллической решетке;
 — гидратированный ион металла в растворе;
— гидратированный ион металла в растворе;
n — валентность металла.
Если погрузить металл не в воду, а в раствор его соли, то активные металлы сохраняют способность посылать свои катионы в раствор, т.е. пластинка металла по-прежнему заряжается отрицательно. При погружении же малоактивного металла в раствор с большой концентрацией ионов этого металла часть этих ионов будет переходить из раствора в кристаллическую решетку металла, заряжая его положительно (рис.4).

Рис.4. Взаимодействие металлов с растворами солей
В этом случае также на границе металл-раствор возникает двойной электрический слой, а значит, и определенная разность потенциалов.
Величина возникающего электродного потенциала зависит от свойств металла, концентрации ионов данного металла в растворе и от температуры. Однако, измерить абсолютные значения электродных потенциалов не удается. Поэтому их измеряют, сравнивая с другим таким же электродным потенциалом, величину которого условно принимают за нуль. В качестве электрода-эталона обычно используют водородный электрод (рис. 5). Водородный электрод представляет собой платиновую пластинку, покрытую рыхлым слоем мелкораздробленной платины и опущенную в 2 н. раствор Н2SО4, имеющий активную концентрацию ионов водорода [Н+] равную 1 моль/л. Через этот раствор под давлением 1 атм при температуре 25 0С (298 К) пропускают газообразный водород, который в большом количестве адсорбируется платиной, в результате чего металлическая поверхность уподобляется поверхности твердого водорода. Газообразный водород, растворяясь в платине, частично диссоциирует на атомы в результате каталитического процесса, и в поверхностном слое устанавливается равновесие  .
.
В свою очередь, на границе электрод-раствор существует равновесие  Катионы водорода переходят в раствор, а сам электрод заряжается отрицательно.
Катионы водорода переходят в раствор, а сам электрод заряжается отрицательно.
Возникающую при равновесии разность потенциалов между стандартным водородным электродом и раствором Н2SО4 называют потенциалом стандартного водородного электрода  и условно принимают за нуль.
и условно принимают за нуль.
|
Для измерения электродных потенциалов составляют гальванический элемент, в котором одним электродом является взятый металл, опущенный в раствор его соли с концентрацией катионов [Men+] = 1 моль/л, а другим электродом — стандартный водородный электрод. Разность потенциалов между этим металлом и стандартным водородным электродом называется стандартным потенциалом металла  .
.
Располагая металлы в порядке возрастания их  , получают электрохимический ряд напряжений металлов (см.приложение).
, получают электрохимический ряд напряжений металлов (см.приложение).
Ряд напряжений металлов характеризует химические свойства металлов.
1.Чем меньшую алгебраическую величину  имеет металл, тем он химически активнее, т.е. тем легче окисляется и труднее восстанавливается из своих ионов.
имеет металл, тем он химически активнее, т.е. тем легче окисляется и труднее восстанавливается из своих ионов.
2.Каждый металл этого ряда, не разлагающий воду, способен вытеснить из растворов солей те металлы, которые стоят после него в ряду напряжений, т.е. имеют бoльшую алгебраическую величину  .
.
3.Водород может быть вытеснен из растворов кислот (кроме НNО3) только теми металлами, которые имеют отрицательные значения  , т.е. стоят до него в ряду напряжений.
, т.е. стоят до него в ряду напряжений.
Электродный потенциал металла, погруженного в раствор его соли с концентрацией катионов [Men+], не равной 1 моль/л, вычисляют по уравнению Нернста:
 , (2)
, (2)
где [Men+×mH2O] — равновесная концентрация катионов металла в растворе;
n — число электронов, участвующих в процессе.
Пример
Определить электродный потенциал цинковой пластины, погруженной в 0,001 М раствор ZnSO4. Стандартный электродный потенциал цинка равен -0,76 В.

Гальванический элемент образуют обычно два различных металла, погруженные в растворы их солей и отделенные друг от друга пористой перегородкой. Возникновение электрического тока в нем обусловлено разностью электродных потенциалов этих металлов. Рассмотрим принцип работы медно-цинкового гальванического элемента (рис.6).

Рис. 6. Схема медно-цинкового гальванического элемента
Состояние равновесия для электродов выражается уравнениями:
 ,
,
 .
.
Способность растворяться у цинка больше, чем у меди, поэтому и концентрация избыточных электронов на цинковом электроде будет больше. Если соединить электроды внешним проводником, то электроны с цинковой пластинки будут переходить на медную. Этот переход электронов нарушит равновесие (1) и новые ионы цинка перейдут в раствор, а на медном электроде будут восстанавливаться ионы меди из раствора ее соли:
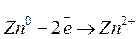 — окислительный процесс
— окислительный процесс
 — восстановительный процесс
— восстановительный процесс
 — ионное уравнение реакции,
— ионное уравнение реакции,
 — молекулярное уравнение реакции в гальваническом элементе.
— молекулярное уравнение реакции в гальваническом элементе.
Однако, если сосуды с растворами не соединены, то в растворе ZnSO4, будут накапливаться катионы Zn2+, а в растворе CuSO4 анионы  , что препятствует дальнейшему протеканию процесса (явление концентрационной поляризации). Во избежание этого оба раствора соединяют трубкой, заполненной раствором электролита, либо разделяют пористой перегородкой, способной пропускать ионы.
, что препятствует дальнейшему протеканию процесса (явление концентрационной поляризации). Во избежание этого оба раствора соединяют трубкой, заполненной раствором электролита, либо разделяют пористой перегородкой, способной пропускать ионы.
Электрод, на котором протекает процесс окисления (в данном случае цинк), называют анодом и обозначают буквой А. Он является источником электронов, поступающих во внешнюю цепь (для внешней цепи цинк является катодом).
Электрод, на котором происходит восстановление, называется катодом (К). В рассматриваемом элементе катодом является медный электрод (для внешней цепи медь — анод).
Гальванический элемент изображается схемой, например:


А(-)Zn ç Zn2+ççCu2+ ç Сu(+) К
где одна черта обозначает границу раздела между электродом и раствором, две черты — границу между растворами, в скобках — знаки полюсов, причем анод записывается слева, а катод — справа.
ЭДС (Е) любого гальванического элемента равна разности электродных потенциалов составляющих его металлов. ЭДС всегда положительная величина. При ее вычислении из потенциала катода вычитают потенциал анода, т.е. из более положительного потенциала вычитают менее положительный.
Например, ЭДС (Е) медно-цинкового элемента, в котором эти металлы погружены в одномолярные растворы их солей, равна разности между стандартными потенциалами меди (катода) и цинка (анода), т.е.

Очевидно, что чем дальше расположены друг от друга в ряду напряжений два данных металла, тем бoльшую ЭДС будет иметь составленный из них гальванический элемент.
Если электроды погружены в растворы их солей, концентрации которых отличаются от 1 моль/л, ЭДС такого элемента вычисляют как разность потенциалов катода и анода, рассчитанных по формуле Нернста (2).
Пример
Определить ЭДС гальванического элемента, составленного из цинка, опущенного в 0,01 М раствор ZnSO4, и серебра, погруженного в 0,001 М раствор AgNO3.
Решение
1. Определяют по уравнению Нернста потенциалы цинкового и серебряного электродов:
 ;
;
 .
.
2. Вычисляют ЭДС гальванического элемента:
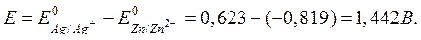
Величины ЭДС работающих гальванических элементов обычно меньше, чем рассчитанные, вследствие торможения протекающих электродных процессов. Торможение анодного процесса приводит к тому, что на аноде накапливаются ионы металла и потенциал анода становится менее отрицательным. Торможение катодного процесса вызывает накопление электронов и потенциал катода становится менее положительным.
Изменение потенциалов электродов при работе гальванического элемента называется поляризацией.
Наибольшее значение имеет торможение катодного процесса или катодная поляризация.
Процесс восстановления окислителя на катоде снимает с него избыточные электроны и тем самым уменьшает поляризацию. Этот процесс называется катодной деполяризацией. Окислители, принимающие электроны на катоде, являются катодными деполяризаторами.
Наиболее распространенными деполяризаторами являются:
1. Катионы металлов, например, Cu2+: 
2. Катионы водорода: 
3. Диоксид марганца: 
Экспериментальная часть
Цель работы:
1. Ознакомиться с рядом напряжений металлов и выводами, вытекающими из него.
2. Ознакомиться с работой гальванического элемента и процессами, протекающими на электродах.
Опыт № 1
Дата добавления: 2019-09-13; просмотров: 485; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

 Рис. 5. Схема гальванического элемента для измерения стандартного электродного потенциала металла
1 — стандартный водородный электрод,
2 — изучаемый металл,
3 — гальванометр,
4 — электролитический мостик
Рис. 5. Схема гальванического элемента для измерения стандартного электродного потенциала металла
1 — стандартный водородный электрод,
2 — изучаемый металл,
3 — гальванометр,
4 — электролитический мостик