Количественные законы электролиза
Связь между массой выделившегося при электролизе вещества и количеством прошедшего через электролит электричества определяется двумя законами Фарадея.
1. Массы веществ, выделившихся на электродах при электролизе, прямо пропорциональны количеству электричества, прошедшего через электролит, и не зависят от других факторов.
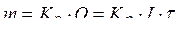 ,
,
где Кэ — электрохимический эквивалент, равный массе вещества, выделившегося при прохождении 1 кулона электричества;
I, t — соответственно сила тока (А) и время (с).
Для выделения 1 эквивалентной массы любого вещества необходимо затратить 96500 Кл. Эту величину называют числом Фарадея (F).
Следовательно, 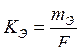 , и масса выделившегося вещества будет равной:
, и масса выделившегося вещества будет равной:
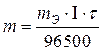 ,
,
где m ¾ масса вещества, выделившегося на электроде, г;
m Э — эквивалентная масса вещества, выделившегося на электроде, г/моль.
2. Одинаковые количества электричества выделяют при электролизе на электродах эквивалентные массы различных веществ:
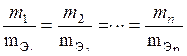 .
.
Если на электродах выделяются газообразные вещества, то объем выделившегося газа:
 ,
,
где V Э – эквивалентный объем газа, л/моль.
Показателем эффективности использования электроэнергии при электролизе является выход по току (h):
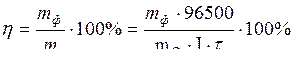 ,
,
где mф — фактически выделившаяся масса вещества, г;
m — теоретически возможная выделившаяся масса вещества, г.
Экспериментальная часть
Цель работы: ознакомиться с основными процессами электролиза с нерастворимыми и растворимыми электродами.
|
|
|
Опыт № 1
Электролиз водного раствора NaCl с нерастворимыми
Электродами
Опыт проводят на установке, схема которой показана на рис. 2.
|
В электролизер налейте до половины раствор NaCl, добавьте в анодное и катодное пространства по 2-3 капли индикатора (фенолфталеина). Вставьте в оба колена трубки графитовые электроды и присоедините их к выпрямителю. После этого включите выпрямитель в сеть и пропускайте ток в течение 5 минут. Отметьте изменение окраски в обоих коленах электролизера. Напишите уравнения катодного и анодного процессов, протекающих при электролизе водного раствора NaCl. Что выделится на катоде и аноде? Объясните изменение окраски индикатора в катодном и анодном пространствах электролизера.
Опыт № 2
Электролиз водного раствора соли двухвалентной меди с нерастворимыми электродами
Заполните электролизер водным раствором СuSO4. В оба колена электролизера опустите графитовые электроды и пропускайте постоянный ток в течение 8-10 минут. Наблюдайте появление на катоде налета меди. Что при этом выделяется на аноде? Напишите уравнения реакций, протекающих на электродах.
|
|
|
Омедненный катод оставьте для проведения опыта № 3.
Опыт № 3
Дата добавления: 2019-09-13; просмотров: 225; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

 Рис. 2. Схема установки для электролиза:
1 — электролизер (U-образная трубка); 2 — графитовые электроды; 3 — раствор электролита;4 — выпрямитель тока
Рис. 2. Схема установки для электролиза:
1 — электролизер (U-образная трубка); 2 — графитовые электроды; 3 — раствор электролита;4 — выпрямитель тока