ОТНОШЕНИЕ МЕТАЛЛОВ К ВОДЕ, КИСЛОТАМ И
ЩЕЛОЧАМ
Теоретическая часть
Важнейшими химическими свойствами металлов являются их отношение к воде, водным растворам кислот и щелочей.
По химической активности (см. табл. «Ряд напряжений») все металлы (Ме) можно разделить на 3 группы:
- Ме высокой активности (Li…Al);
- Ме средней активности (после Al и до Н2);
- Ме неактивные (после Н2).
1. Отношение металлов к воде
Во взаимодействии металлов с водой при комнатной температуре наблюдаются следующие случаи:
1) Металлы восстанавливают водород из воды, образуя растворимые гидроксиды (щелочи) или малорастворимые гидроксиды по следующей схеме:
 ,
,
где n – валентность Ме.
Эти реакции свойственны для всех металлов от Li доAl включительно (Al должен быть очищен от оксидной пленки или нагрет).
 ,
,
 ,
,
 .
.
2) Металлы, расположенные в ряду напряжений между Al и Н2 (Ме средней активности) реагируют с водой при температурах 500…7000С, т.е. реагируют с перегретым водяным паром, образуя оксид и выделяя водород. Например,
 ,
,
 .
.
3) Металлы, расположенные в ряду напряжений после Н2 (неактивные Ме) вытеснить водород из воды не могут ни при каких условиях.
2. Отношение металлов
к разбавленным кислотам (кроме азотной)
Основным фактором оценки отношения металлов к разбавленным кислотам (кроме азотной), является их положение в таблице “Ряд напряжений”.
1) Металлы, стоящие в ряду напряжений до водорода, т.е. имеющие отрицательные значения стандартных электродных потенциалов  , растворяются в разбавленных кислотах с выделением водорода.
, растворяются в разбавленных кислотах с выделением водорода.
|
|
|
Например:
 ,
,
 .
.
В качестве окислителя при этом выступает ион водорода  в молекулах кислот.
в молекулах кислот.
2) Металлы, имеющие положительные значения стандартных электродных потенциалов  , с разбавленными кислотами не взаимодействуют. К числу таких металлов относятся: Аu, Аg, Ru, Rh, Pd, Os, Ir, Pt, а также Cu, Hg, Вi.
, с разбавленными кислотами не взаимодействуют. К числу таких металлов относятся: Аu, Аg, Ru, Rh, Pd, Os, Ir, Pt, а также Cu, Hg, Вi.
Например:
 ,
,
 .
.
Однако, следует иметь в виду, что рядом напряжений следует пользоваться с учетом особенностей рассматриваемых реакций. Так, свинец  практически не растворяется в разбавленной соляной и серной кислотах вследствие образования на его поверхности нерастворимых хлоридной и сульфатной пленок (происходит пассивирование):
практически не растворяется в разбавленной соляной и серной кислотах вследствие образования на его поверхности нерастворимых хлоридной и сульфатной пленок (происходит пассивирование):
 ;
;
 .
.
Отношение металлов к разбавленной азотной кислоте
Азотная кислота обладает ярко выраженной окислительной активностью. Роль окислителя в ней выполняет не ион Н+, а ион 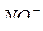 ,
,  , поэтому водород из азотной кислоты не вытесняется.
, поэтому водород из азотной кислоты не вытесняется.
В зависимости от активности Ме, реагирующего с разбавленной
НNO3, восстановление  идет по следующей схеме:
идет по следующей схеме:
(NH3 + HNO3) = 

 - Ме от Li до Al
- Ме от Li до Al
+8ē
+5ē  - Me от Al до Cd
- Me от Al до Cd
|
|
|

+4ē
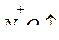 - Me от Cd до H2
- Me от Cd до H2
+3ē
 - Me после H2
- Me после H2
Не реагируют с HNO3(р) благородные металлы, кроме серебра и палладия. Например:
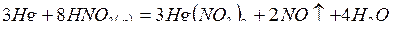 ;
;
 ;
;
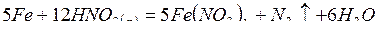 ;
;
 ;
;
4. Отношение металлов
к концентрированной азотной кислоте и “царской водке”
В концентрированной азотной кислоте так же, как и в разбавленной, роль окислителя выполняет ион 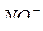
 .
.
Восстановление  идет по следующей схеме:
идет по следующей схеме:
 +3ē
+3ē  (Ме от Li до Al)
(Ме от Li до Al)

+ē  (остальные Ме)
(остальные Ме)
Например,
 ;
;
 ;
;
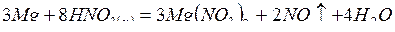 .
.
Концентрированная азотная кислота (С ³ 70 %) не реагирует:
1) с благородными металлами (кроме Аg и Рd);
2) с пассивирующимися металлами, на поверхности которых легко образуется пленка малорастворимых оксидов. Наличием защитной оксидной пленки объясняется пассивность данных металлов по отношению к концентрированным растворам кислот-окислителей на холоду. К числу пассивирующихся металлов относятся Ве, Аl, Тi, Zn, Нf, V, Мn, Сr, Мо, W, Fе, Со, Ni, Вi. В горячей концентрированной азотной кислоте пассивирующиеся Ме растворяются.
Смесь азотной и соляной кислот в соотношении 1:3 (“царская водка”) — более активный окислитель, чем азотная кислота. Название (царская водка) происходит от того, что эта смесь растворяет «царя металлов» золото и другие благородные Ме. Так Аu и Рt легко растворяются в ней с образованием соответствующих хлоридов:
|
|
|

 .
.
5. Отношение металлов
к концентрированной серной кислоте
При действии концентрированной серной кислоты на металлы роль окислителя играет не ион Н+, как в разбавленной Н2SО4, а ион  поэтому водород не выделяется, а образуются соединения серы (SО2, S или Н2S).
поэтому водород не выделяется, а образуются соединения серы (SО2, S или Н2S).
Восстановление  идет по следующей схеме в зависимости от активности растворяющегося Ме:
идет по следующей схеме в зависимости от активности растворяющегося Ме:
 +8ē
+8ē  (Me от Li до Al)
(Me от Li до Al)
 +6ē
+6ē  (Ме от Al до H2)
(Ме от Al до H2)
+2ē  (Ме после Н2)
(Ме после Н2)
Например:
 ;
;
 ;
;
 .
.
Не растворяются в концентрированной серной кислоте:
1) благородные Ме, кроме Ag и Pd;
2) если  ≥ 90%, то на холоду не растворяются пассивирующиеся Ме; в горячей концентрированной серной кислоте пассивирующиеся Ме растворяются.
≥ 90%, то на холоду не растворяются пассивирующиеся Ме; в горячей концентрированной серной кислоте пассивирующиеся Ме растворяются.
Например:
 ,
,
 .
.
Необходимо отметить, что в реакциях концентрированной серной кислоты с металлами, стоящими в ряду напряжений до водорода, в зависимости от условий протекания реакции (концентрация кислоты и температура) может выделиться любое из соединений серы (SO2, S, или H2S). Чем меньше концентрация кислоты, тем более вероятно самое глубокое восстановление  металлом (выделение сероводорода Н2S).
металлом (выделение сероводорода Н2S).
|
|
|
6. Отношение металлов
к водным растворам щелочей
С водными растворами щелочей могут реагировать металлы (Ве, Аl, Zn, Sn, Рb), дающие амфотерные гидроксиды. В результате образуется комплексная соль данного металла и выделяется водород.
Например:
 ,
,
 — тетрагидроксоалюминат натрия,
— тетрагидроксоалюминат натрия,
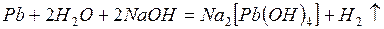 ,
,
 — тетрагидроксоплюмбат натрия.
— тетрагидроксоплюмбат натрия.
Экспериментальная часть
Цель работы: изучить отношение некоторых технически важных металлов к воде, водным растворам кислот и щелочей.
Опыт № 1
Отношение металлов к воде
В пять пробирок налейте по 2-3мл Н2О. В первую пробирку поместите кусочек Nа, во вторую — кусочек Са, в третью насыпьте немного порошка Мg, в четвертую — железные опилки, в пятую — медную стружку. Третью, четвертую и пятую пробирки подогрейте. Что наблюдается? Во все пробирки добавьте по 2-3 капли фенолфталеина. Во всех ли пробирках изменилась окраска? Почему? Какие металлы не вступают во взаимодействие с водой? Объясните причину. Составьте уравнения реакций.
Опыт № 2
Дата добавления: 2019-09-13; просмотров: 2345; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
