Воздействие на среду с целью снижения ее коррозионной активности
Обработку коррозионной среды проводят, в основном, введением специальных веществ, замедляющих коррозию (ингибиторов). По характеру защитного действия ингибиторы подразделяются на анодные, катодные и органические. Анодные ингибиторы — это вещества, являющиеся окислителями (хроматы, дихроматы, нитриты). Они образуют на анодной поверхности металла или сплава пассивные оксидные пленки (d~0,1мкм) и уменьшают скорость его растворения. К катодным ингибиторам относятся вещества, тормозящие отдельные стадии катодного процесса. Они либо снижают концентрацию кислорода в растворе (например, Na2SO3), либо сокращают поверхность катодных участков (например, ZnSO4, ZnCl2,) за счет образования нерастворимых гидрооксидов Zn(OH)2, которые, осаждаясь на поверхности металла, изолируют катодные участки.
Органические ингибиторы (альдегиды, аминосоединения и т.д.) адсорбируются на катодных и анодных участках металла, тем самым изолируя их активную поверхность.
Изменение состава или структуры металла
С одной стороны, применение чистых металлов предотвращает образование гальванических пар и замедляет коррозию. С другой стороны, легирующие добавки (Ni, Cr,Ti, V и др.) могут существенно повысить коррозионную стойкость металлов. Например, сталь содержащая 0,12%С, 18%Cr, 10%Ni и до 1,5%Ti становится нержавеющей (сталь 12Х18Н10Т).
Электрохимическая защита
а) Протекторная защита (рис.1).
|
|
|
К защищаемому сооружению присоединяют более активный в данной среде металл, который выполняет роль анодного протектора и испытывает разрушение, а защищаемый объект (катод) остается неизменным. Протектор периодически возобновляется. Этот метод применяют для защиты от коррозии лопастей турбин, подводных частей кораблей, химической аппаратуры и др.
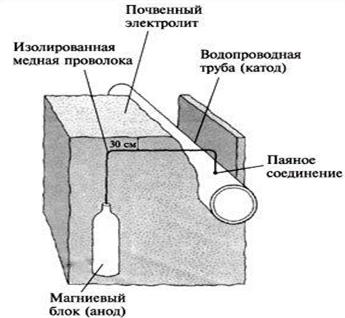
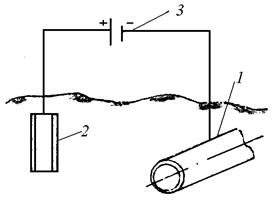
Рис. 1. Схема протекторной защиты
б) Катодная электрозащита (рис.2).
|
Рис. 2.Схема катодной электрозащиты:
1 — защищаемое сооружение, 2 — ненужный металл (анод), 3 — источник постоянного тока
Защищаемое металлическое сооружение присоединяют к отрицательному полюсу внешнего источника постоянного тока, а к положительному полюсу — кусок ненужного металла. Металл сооружения, получая электроны от внешнего источника, становится катодом и, следовательно, не разрушается. Разрушению подвергается кусок ненужного металла (анод), отдающий электроны внешнему источнику тока. Катодную электрозащиту обычно применяют для защиты сооружений из черных металлов, находящихся в нейтральных средах, содержащих кислород (подземные трубопроводы, опоры ЛЭП и др.).
в) Анодная электрозащита.
Защищаемый объект подключают к положительному полюсу источника постоянного тока, т.е. искусственно делают анодом. Растворение защищаемого металла сначала увеличивается, но затем при достижении определенного значения потенциала наступает пассивное состояние вследствие образования защитной оксидной пленки (если среда не содержит депассиваторов). Для поддержания в последующем пассивного состояния требуется незначительная плотность анодного тока.
|
|
|
Создание рациональных конструкций
Эффективным методом борьбы с коррозией является рациональное конструирование металлических сооружений, в которых до минимума сведены неблагоприятные в коррозионном отношении контакты металлов и воздействия иных вызывающих коррозию факторов (скопление грязи, влаги, неоднородной оксидной пленки на поверхности металла).
Экспериментальная часть
Цель работы: ознакомиться с некоторыми способами защиты металлов от коррозии.
Опыт № 1
Анодное и катодное покрытия
В два стакана емкостью 50 мл налейте по 10 мл 3%-ного раствора хлорида натрия и добавьте по 5-6 капель раствора К3[Fe(CN)6]. В один стакан опустите пластинку оцинкованного железа, а в другой — пластинку луженого железа, предварительно сделав на их поверхности в отдельных местах глубокие царапины. Что наблюдается? Какой образец быстрее подвергается коррозии?
|
|
|
Объясните результаты опыта, составьте схему действия образующихся коррозионных гальванических пар.
Опыт № 2
Протекторная защита
В два стакана емкостью 50 мл налейте по 10 мл 0,2 - 0,4 н. раствора уксусной кислоты и добавьте по 5-6 капель КI. В один стакан поместите образцы цинка и свинца в контакте друг с другом, а в другой стакан - один свинец. Где быстрее появится золотисто-желтое окрашивание, обусловленное образованием иодида свинца? Объясните результаты опыта. Составьте схему действия образующейся гальванопары.
Опыт № 3
Катодная электрозащита
Налейте в прибор для электролиза (см.лаб.раб.№ 10) 3% раствор хлорида натрия и добавьте 8-10 капель раствора К3[Fe(CN)6]. Угольный электрод (анод) подключите к положительному полюсу источника постоянного тока. В качестве катода используйте стальной (нелегированный) стержень, который соедините с отрицательным полюсом источника. Пропускайте электрический ток. Для сравнения другой такой же образец опустите в стакан емкостью 200 мл, куда предварительно налейте 50 мл того же электролита и добавьте 5-6 капель раствора К3[Fe(CN)6]. Что наблюдается? Где быстрее развивается коррозия? Объясните результаты.
|
|
|
Опыт № 4
Применение ингибиторов
В три пробирки налейте по 5 мл 1н.раствора соляной кислоты. В одну из них поместите кусочек цинка, в другую - железные стружки, в третью - гранулу алюминия. Если реакция протекает медленно, пробирки подогрейте. Когда выделение водорода станет интенсивным, добавьте в каждую из пробирок немного уротропина. Какой наблюдается эффект? Во всех ли случаях уротропин является активным ингибитором?
Контрольные вопросы
1. Какие существуют методы защиты от коррозии? Охарактеризуйте каждый из них.
2. Что такое анодное и катодное покрытие? Приведите примеры.
3. Что такое ингибиторы? В каких случаях их применяют?
4. Приведите примеры электрохимической защиты в промышленности.
5. В каком случае коррозия железа протекает интенсивнее:
а) луженого;
б) оцинкованного?
Составьте схемы работы гальванопар.
Лабораторная работа № 14
Дата добавления: 2019-09-13; просмотров: 281; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!