Электролиз растворов электролитов с нерастворимыми электродами
Особенностью электролиза растворов является наличие в них наряду с ионами электролита молекул воды, которые участвуют в процессах, протекающих на электродах.
В зависимости от величины электродного потенциала металла и природы солеобразующей кислоты электролиз водных растворов солей металлов протекает по-разному. Необходимо руководствоваться следующими правилами:
1. Из анионов электролитов в первую очередь разряжаются анионы бескислородных кислот (Cl-, Br-, S2- и т.д., кроме F-), т. к. приобретенные ими электроны удерживаются слабее, чем собственные электроны кислорода в молекулах воды.
2. Анионы кислородосодержащих кислот ( 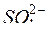 ,
, 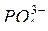 и т.д.) в присутствии воды не разряжаются: электроны в них связаны прочнее, чем в молекулах воды, которые и разряжаются в первую очередь.
и т.д.) в присутствии воды не разряжаются: электроны в них связаны прочнее, чем в молекулах воды, которые и разряжаются в первую очередь.
3. Катионы металлов высокой активности, имеющих небольшую (-3,02…-1,66 В) величину электродного потенциала («активные металлы»), в частности, Li...Al, на катоде не восстанавливаются, т.к. катодный потенциал разряда их больше, чем воды, которая и восстанавливается в первую очередь. Например, электролиз растворов КВr и NaNO3 протекает по схемам:
КВr:
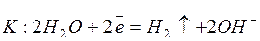 ;
;
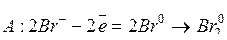 ;
;
NaNO3:
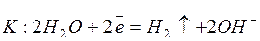 ;
;
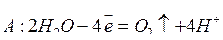 .
.
4. Катионы металлов средней активности, расположенных в ряду напряжений после алюминия до водорода (Mn…Pb), восстанавливаются наравне с молекулами воды (вследствие перенапряжения водород как бы смещается в ряду напряжений в область более отрицательных значений электродных потенциалов).
|
|
|
Например, электролиз раствора NiSO4 протекает по схеме:
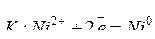 ;
;
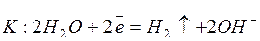 ;
;
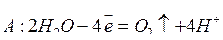 .
.
5. Катионы неактивных металлов, имеющих положительные значения электродных потенциалов (Сu...Au), восстанавливаются в первую очередь, т.к. имеют меньший, чем у воды, катодный потенциал разряда.
Например, электролиз раствора СuCl2 протекает по схеме:
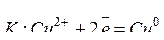 ;
;
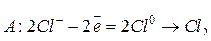 .
.
Электролиз растворов электролитов с растворимым анодом
В этом случае источником электронов, поступающих во внешнюю цепь, служит не анионы электролита (как при электролизе с нерастворимыми электродами), а металл анода, который «отдает» электроны источнику постоянного тока, а сам в виде катионов переходит в раствор.
Например, электролиз раствора CuSO4 c медным анодом протекает по схеме:
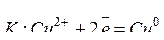 ;
;
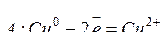 .
.
Т.е. металл с анода переносится на катод. Электролиз раствора NiSO4 c никелевым анодом протекает по схеме:
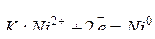 ;
;
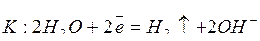 ;
;
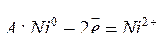 .
.
Электролиз растворов с растворимым анодом широко используется в технике (гальваностегия, рафинирование металлов, гальванопластика и др.).
Электролиз расплавов
Электрический ток, как известно, является наиболее мощным окислителем и восстановителем.
Катионы таких активных металлов, как щелочные, щелочно-земельные, алюминий, не способные восстанавливаться из водных растворов их соединений, в основном могут быть восстановлены из расплавов этих соединений (пироэлектрометаллургический способ получения металлов). Например, при электролизе расплава NaCl протекает следующие процессы:
|
|
|
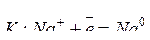 ;
;
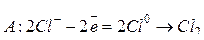 .
.
Так, свободный фтор, анионы которого химическим путем окислить невозможно, получают электролизом расплавов фторидов металлов.
Если электролизу подвергается расплав, содержащий катионы различных металлов, последовательность их восстановления определяется величиной электродных потенциалов этих металлов; в первую очередь восстанавливаются катионы металла, обладающего большим значением электродного потенциала.
Дата добавления: 2019-09-13; просмотров: 205; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
