Смещение равновесия гидролиза
Налейте в пробирку 2–3 капли концентрированного раствора хлорида железа (III) FeCl3 (соль образована слабым основанием и слабой кислотой, ее гидролиз протекает в основном только по 1-й ступени), а затем добавьте по каплям концентрированный раствор карбоната натрия Na2CO3 (соль образована, напротив, сильным основанием и слабой кислотой, ее гидролиз также протекает в основном только по 1-й ступени) до появления осадка и выделения газа. В результате сливания двух вышеуказанных растворов происходит образование соли, полученной из слабых оснований и кислоты. Эта соль подвергается полному гидролизу. Напишите молекулярные и ионные уравнения реакции.
Контрольные вопросы
1. Что такое гидролиз солей? Дайте определение.
2. Какие соли подвергаются гидролизу? Приведите примеры.
3. Как рассчитать константу гидролиза?
4. Какие факторы влияют на гидролиз солей и почему?
5. Как влияет нагревание раствора на протекание гидролиза?
6. Как влияет разбавление на протекание гидролиза?
7. Составьте молекулярные и ионные уравнения гидролиза следующих солей: ZnBr2, Fe2(SO4)3, KNO2, K2SO3, СH3COONa, Pb(NO3)2, NH4Cl, Na2S, K3PO4, В какой цвет будет окрашен универсальный индикатор в растворах этих солей?
Лабораторная работа № 8
ЖЕСТКОСТЬ ВОДЫ
Теоретическая часть
Жесткость воды — мера содержания в воде солей двухвалентных металлов, прежде всего кальция и магния.
Различают карбонатную(временную), некарбонатную (постоянную) и общую жесткость.
|
|
|
Карбонатная жесткость (ЖК) обусловлена содержанием в воде гидрокарбонатов кальция Са(НСО3)2 и магния Мg(НСО3)2. При кипячении воды гидрокарбонаты кальция и магния разлагаются с образованием труднорастворимых карбонатов, выпадающих в осадок, вследствие чего жесткость воды уменьшается:
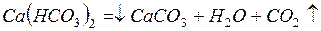 ;
;
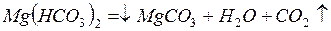 .
.
Поэтому карбонатная жесткость называется временной.
Некарбонатная жесткость (ЖН), обусловленная наличием в воде хлоридов и сульфатов кальция и магния (СаCl2, МgCl2, СаSО4, МgSO4), кипячением воды не устраняется и называется постоянной.
Общая жесткость воды (ЖОБЩ) определяется общим содержанием солей, т.е. представляет собой сумму карбонатной и некарбонатной жесткости:
ЖОБЩ = ЖК + ЖН, (1)
Жесткость выражают числом миллиэквивалентов (мэкв) ионов кальция и магния, содержащихся в 1 л воды:
1 мэкв Са2+ = 20,04 мг,
1 мэкв Мg2+ = 12,16 мг.
Общая жесткость воды может быть рассчитана по формуле:
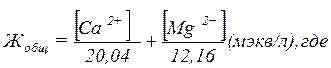
[Са2+] и [Мg2+] — концентрация ионов кальция и магния в исследуемой воде, мг/л.
Жесткость природных вод колеблется в широких пределах. Вода с жесткостью менее 4мэкв/л относится к категории мягких, от 4 до 8мэкв/л - к водам средней жесткости, от 8 до 12мэкв/л - к жестким и выше 12мэкв/л - к очень жестким.
|
|
|
Наиболее мягкой является родниковая вода. Мягкая вода характерна для большинства рек, например, для Днепра — 3,7 мэкв/л, для Невы — 0,5мэкв/л. Наибольшей жесткостью обладают воды морей и океанов. К примеру, общая жесткость воды Черного моря достигает 65,5мэкв/л.
Присутствие в воде значительного количества солей кальция и магния делает воду совершенно непригодной для технических целей.
При питании паровых котлов жесткой водой на их стенках образуется накипь, которая резко снижает теплопроводность стенок котла, вследствие чего увеличивается расход топлива. Так, при толщине слоя накипи 6мм расход топлива увеличивается приблизительно на 50%. Кроме того, из-за накипи перегреваются стенки парового котла, что может вызвать его взрыв.
Жесткая вода не дает пены с мылом, т.к. содержащиеся в мыле растворимые натриевые соли жирных кислот (пальмитиновой и стеариновой) переходят в нерастворимые кальциевые соли тех же кислот:
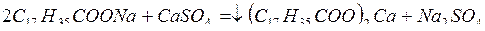 .
.
Это происходит до тех пор, пока из раствора не будут удалены все ионы кальция. Поэтому применение жесткой воды в коммунальном хозяйстве и в быту вызывает непроизводительную трату мыла. Жесткой водой нельзя пользоваться при проведении некоторых технологических процессов, например, при крашении.
|
|
|
Приведенные примеры указывают на необходимость тщательной очистки воды, применяемой для технологических целей, от солей кальция и магния.
Способы устранения жесткости весьма разнообразны. Возможно частичное смягчение воды или полное ее обессоливание.
Временную жесткость воды можно устранить кипячением. Однако, использование данного метода приводит к образованию накипи в нагревательных приборах.
Более распространенными промышленными способами удаления жесткости являются химические способы, которые сводятся к обработке воды реактивами, образующими осадки с солями кальция и магния. В качестве таких реактивов применяют ортофосфат натрия (Nа3РО4), буру (Nа2В4О7), соду (Nа2СО3) и др.
При химической очистке воды чаще всего используется известково-содовый способ, основанный на применении гашеной извести Са(ОН)2 и соды Nа2СО3.
Реакции, протекающие при введении извести, можно выразить молекулярными уравнениями:
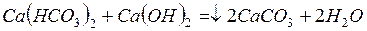 ;
;
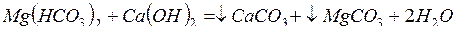 .
.
Таким образом, известь снижает временную жесткость воды.
Сода осаждает сульфаты и хлориды кальция и магния по схемам:
 ;
;
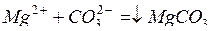 .
.
т.е. снижает постоянную жесткость.
В настоящее время большое значение в технике очистки воды приобрел катионитный метод (метод ионного обмена). Он осуществляется с помощью цеолитов, пермутитов и органических смол — ионитов.
|
|
|
Цеолиты и пермутиты — это соединения, относящиеся к группе алюмосиликатов, состав которых может быть выражен общей формулой 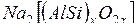 , или, обозначая кислотный остаток через П, более просто Nа2П. Цеолиты встречаются в природе, а пермутиты получаются сплавлением кремнезема (SiO2), глинозема (Аl2О3) и соды (Nа2СО3). Эти алюмосиликаты имеют рыхлую кристаллическую структуру и способны обменивать ион натрия на ионы кальция и магния:
, или, обозначая кислотный остаток через П, более просто Nа2П. Цеолиты встречаются в природе, а пермутиты получаются сплавлением кремнезема (SiO2), глинозема (Аl2О3) и соды (Nа2СО3). Эти алюмосиликаты имеют рыхлую кристаллическую структуру и способны обменивать ион натрия на ионы кальция и магния:
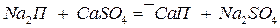 ;
;
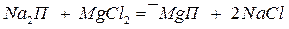 .
.
Пермутит кальция или магния при обработке концентрированным раствором поваренной соли регенерируется (восстанавливается) в пермутит натрия, который вновь используется для очистки воды. Однако, цеолиты и пермутиты обладают небольшой обменной емкостью; ее максимальное значение — около 2 мэкв/л.
Для очистки вод, богатых сульфатами, наилучшим является баритный способ, по которому в качестве очищающего вещества применяется нерастворимый карбонат бария ВаСО3. Например,
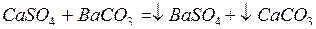 .
.
(оба продукта реакции нерастворимы).
Удаление образовавшихся в котле отложений обычно производят растворами кислот и щелочей. Из кислот чаще всего применяют соляную с добавками ингибиторов коррозии (уротропина, столярного клея и др.). Щелочные растворы разрыхляют осадки и облегчают их механическое удаление.
Для предупреждения образования накипи непосредственно в паровые котлы добавляют так называемые антинакипины, переводящие катионы кальция и магния (Са2+ и Мg2+) в легко удаляемый осадок. При этом в котле поддерживают либо определенную концентрацию  и ОН
и ОН 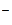 (щелочной режим),либо
(щелочной режим),либо 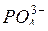 и ОН
и ОН 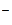 (фосфатный режим) добавлением к воде Nа2СО3 и NаОН или Nа3РО4 и NаОН.
(фосфатный режим) добавлением к воде Nа2СО3 и NаОН или Nа3РО4 и NаОН.
Определение жесткости воды производят с помощью метода титрования.
Гидрокарбонаты кальция и магния, придающие воде временную жесткость, титруют соляной кислотой в присутствии индикатора метилоранжа. При этом прибавляемая соляная кислота расходуется на разложение гидрокарбонатов кальция и магния:
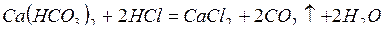 ;
;
 .
.
Как только в растворе появится очень небольшой избыток кислоты, окраска метилоранжа изменится от желтой (щелочная реакция среды, обусловленная наличием гидрокарбонатов) до оранжевой.
Расчет карбонатной жесткости воды производят по формуле (2):
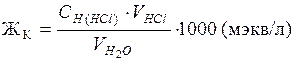 , (2)
, (2)
где CН (НСl) — нормальность кислоты, моль/л;
VHCl — объем кислоты, затраченный на титрование, мл;
VН2О — объем воды, взятой для исследования, мл.
При определении общей жесткости воду титруют раствором трилона “Б” (двухзамещенная натриевая соль этилендиаминтетрауксусной кислоты) в присутствии индикатора хромогена черного.
Сущность метода заключается в том, что катионы Са2+ и Мg2+, придающие воде жесткость, образуют с хромогеном черным менее прочные комплексные соединения, чем с трилоном “Б”. В щелочной среде (рН»8-11) добавленный к воде индикатор связывает Са2+ и Мg2+ в комплексы, окрашенные в красно-фиолетовый цвет. При титровании воды трилоном “Б” комплексные соединения катионов Са2+ и Мg2+ с хромогеном черным разрушаются, а вместо них образуются не имеющие окраски внутрикомплексные соединения ионов данных металлов с трилоном “Б”. Поэтому в точке эквивалентности красно-фиолетовая окраска раствора переходит в синюю — цвет самого индикатора.
Общую жесткость воды вычисляют по формуле:
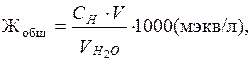 (3)
(3)
где CH — нормальность трилона “Б”, моль/л;
V —объем раствора трилона“Б”,пошедший на титрование, мл;
VН2О—объем взятой для исследования водопроводной воды, мл.
Экспериментальная часть
Цель работы: Ознакомиться с лабораторными методами определения общей и временной жесткости воды.
Опыт № 1
Определение карбонатной (временной) жесткости воды (ЖК)
В коническую колбу емкостью 250мл налейте с помощью мерного цилиндра 100мл водопроводной воды и добавьте туда 2-3 капли индикатора метилоранжа. Какую окраску имеет индикатор?
Оттитруйте пробу воды при постоянном перемешивании 0,1 н. раствором соляной кислоты до появления оранжевой окраски.
Титрование проведите 3 раза, запишите его результаты в таблицу 1.
Таблица 1.
Форма записи результатов экспериментов
| № п/п | Объем воды, взятый для трования, мл | Объем 0,1н. раствора НСl, пошедший на титрование, мл |
| 1. | 100 | |
| 2. | 100 | |
| 3. | 100 | |
| Среднее значение, V = | ||
Расчет карбонатной жесткости произведите по формуле (2).
Опыт № 2
Определение общей жесткости воды (ЖОБЩ)
В коническую колбу на 250 мл налейте 100 мл исследуемой воды, добавьте 10 мл аммиачной буферной смеси (для того, чтобы под-держивалось постоянное значение рН) и 1/3 микрошпателя индикатора хромогена черного. Какую окраску имеет раствор? Оттитруйте воду, постоянно перемешивая содержимое колбы, 0,1н. раствором трилона “Б” до появления синей окраски. Повторите опыт еще 2 раза.
Результаты опытов запишите в таблицу 2.
Таблица 2.
Форма записи результатов опыта
| № п/п | Объем воды, взятый для титрования, мл | Объем 0,1 н. раствора трилона “Б”, пошедший на титрование, V мл |
| 1. | 100 | |
| 2. | 100 | |
| 3. | 100 | |
| Среднее значение V = | ||
По среднему значению V рассчитайте общую жесткость воды, воспользовавшись формулой (3).
Некарбонатную (постоянную) жесткость вычислите по формуле (1).
Контрольные вопросы
1. Что называется жесткостью воды? В каких единицах она измеряется?
2. Какие виды жесткости воды Вы знаете?
3. Какие соли обусловливают временную жесткость воды? Постоянную?
4. Введением, каких ионов можно умягчить воду? Составьте уравнения соответствующих реакций.
5. Назовите промышленные способы устранения жесткости. Какие из них являются наиболее распространенными?
6. С помощью какого метода определяется общая и временная жесткость воды? В чем сущность данного метода?
Лабораторная работа № 9
Дата добавления: 2019-09-13; просмотров: 213; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
