Влияние величины поверхности реагирующих веществ на скорость химической реакции в гетерогенной системе
Отберите два одинаковых по размерам (примерно с горошину) кусочка мела. Один из кусочков разотрите на фильтровальной бумаге в мелкий порошок (с помощью шпателя или стеклянной палочки). Порошок и кусочек мела поместите в две разные пробирки. В обе пробирки одновременно прибавьте по 5 мл 10%-ного раствора соляной кислоты. В какой из пробирок реакция идет быстрее и почему? Напишите уравнение реакции.
Опыт № 5
Влияние изменения концентрации реагирующих веществ на химическое равновесие
О смещении химического равновесия в реакции:
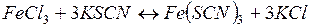
можно судить по изменению интенсивности красного окрашивания, обусловленного образованием роданида железа Fe(SCN)3. Так как реакция обратима, то при смещении равновесия влево интенсивность окраски ослабевает.
Налейте в небольшой стакан 6 мл 0,02 н. раствора FeCl3 и добавьте 6 мл 0,01 н. раствора KSCN (или NH4SCN). Полученный раствор тщательно перемешайте стеклянной палочкой, после чего разлейте поровну в четыре пробирки. В первую пробирку добавьте 3-5 капель концентрированного раствора FeCl3, во вторую 2-3 капли концентрированного раствора KSCN, в третью насыпьте немного кристаллического KCl (или NH4Cl) и встряхните пробирку несколько раз, чтобы ускорить растворение соли. Четвертую пробирку оставьте в качестве контрольной.
Сопоставьте интенсивность окраски полученных растворов с цветом содержимого четвертой (контрольной) пробирки и, используя принцип Ле Шателье, объясните наблюдаемое изменение окраски в первых трех пробирках.
|
|
|
Результаты опытов запишите в таблицу 3.
Таблица 3.
Форма записи результатов наблюдений.
| Номер пробирки | Добавленное вещество | Изменение интенсивности окраски (усиление, ослабление) | Направление смещения равновесия |
| 1. | FeCl3 | ||
| 2. | KSCN | ||
| 3. | KCl | ||
| 4. | - |
Контрольные вопросы
1. Как формулируется закон действующих масс?
2. Какой физический смысл константы скорости реакции?
3. Как формулируется принцип Ле Шателье?
4. Что такое энергия активации?
5. Как изменится скорость реакции образования NО:
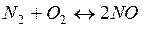 , если давление в системе увеличивается в 2 раза?
, если давление в системе увеличивается в 2 раза?
6. В какую сторону сместится равновесие системы:
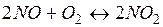 , DН>0:
, DН>0:
а) при нагревании,
б) при увеличении давления?
Лабораторная работа № 6
РАСТВОРЫ
Теоретическая часть
Раствором называется твердая, жидкая или газообразная гомогенная система, состоящая из двух или более компонентов, относительные количества которых могут изменяться в широких пределах.
Компонентами, составляющими раствор, являются растворитель и растворенное вещество. Растворителем условно принято считать вещество, агрегатное состояние которого не изменяется при образовании раствора. Растворенное вещество меняет свое агрегатное состояние.
|
|
|
Например, водный раствор хлорида натрия состоит из двух компонентов: Н2О и NaCl. Вода не изменила агрегатное состояние, поэтому она растворитель. Хлорид натрия был твердым, при растворении в воде распался на ионы Na+ и Cl¯ и принял агрегатное состояние растворителя, поэтому NаСl — растворенное вещество.
Если один из компонентов раствора — жидкость, а другой — твердое вещество или газ, то растворителем является жидкость независимо от того, какой из компонентов преобладает в растворе. При одинаковом агрегатном состоянии обоих компонентов обычно растворителем считают то вещество, которое преобладает в растворе, делая исключение только для Н2О.
Наибольшее значение имеют жидкие растворы и особенно те, в которых растворителем является вода. В воде могут растворяться твердые, жидкие и газообразные вещества. Свойство вещества растворяться в воде или другом растворителе называется растворимостью. Количественно растворимость выражается концентрацией насыщенного раствора.
Концентрацией называется содержание растворенного вещества в определенной массе или известном объеме раствора или растворителя. Раствор, в котором при данных условиях содержится максимально возможная масса растворенного вещества, называется насыщенным. Если концентрация раствора меньше концентрации насыщенного, то он называется ненасыщенным, а если больше — пересыщенным. Пересыщенные растворы неустойчивы, поэтому встряхивание или введение в раствор кристаллика соли вызывает выпадение в осадок избытка растворенного вещества.
|
|
|
Концентрацию раствора можно выражать по-разному. Рассмотрим наиболее распространенные способы выражения концентраций растворов.
Массовый процент (процентная концентрация)
Массовая процентная концентрация (С%) показывает число граммов (единиц массы) вещества, содержащееся в 100 граммах (единицах массы) раствора. Например, выражение “3%-ный раствор КОН” означает, что в каждых 100 г раствора содержится 3 г КОН и 97г Н2О.
Пример
Вычислить процентную концентрацию раствора, полученного при растворении 25 г соли в 100 г воды.
Решение
Масса раствора составляет 125г. Процентную концентрацию раствора находим из пропорции:
125 г раствора — 25 г соли
100 г раствора — х г соли
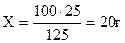 .
.
Следовательно, раствор является 20%-ным.
|
|
|
Молярная концентрация
Молярная концентрация (СМ) определяется числом молей растворенного вещества, содержащихся в 1л раствора. Для обозначения молярной концентрации пользуются буквой М. Так, 0,1М НСl означает раствор соляной кислоты, в каждом литре которого содержится одна десятая часть моля НСl.
Растворы, содержащие 2, 3, 4 и т.д. моля растворенного вещества в 1л раствора, называются двумолярными (2М), трехмолярными (3М), четырехмолярными (4М) и т.д. Растворы, содержащие в 1л доли молей, (например, 0,1; 0,2; 0,01; 0,001), называются соответственно децимолярными (0,1М), двудецимолярными (0,2М), сантимолярными (0,01М), миллимолярными (0,001) и т.д.
Пример
Вычислить молярную концентрацию раствора, в 200 мл которого содержится 10 г Н2SО4.
Решение
Находим массу Н2SО4 в 1 л раствора:
200 мл р-ра — 10 г Н2SО4
1000 мл р-ра — х г Н2SО4
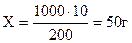 .
.
Молярная масса Н2SО4 равна 98 г/моль. Число молей, содержащееся в 50г:50/98 » 0,5. Следовательно, имеем ~ 0,5 М раствор Н2SО4.
Моляльная концентрация (моляльность)
Моляльная концентрация (Сm) выражается числом молей растворенного вещества в 1кг чистого растворителя. Обозначается моляльность буквой m. Например, 2m H2SО4 означает раствор, в котором на 1кг воды приходится 2 моля Н2SО4.
Пример
Вычислить моляльную концентрацию 2%-ного раствора КСl.
Решение
Раствор данной концентрации имеет состав: 2 г КСl и 98 г Н2О. Находим массу КСl в 1 кг Н2О:
2 г КСl — 98 г Н2О
Х г КCl — 1000 г Н2О
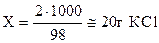 .
.
Молярная масса КСl равна 74,5г/моль. Число молей КСl содержащееся в 20 г: 20/74,5 = 0,27. Раствор — 0,27 моляльный.
Молярная доля
Молярная доля компонента в растворе равна отношению числа молей данного компонента к сумме чисел молей всех компонентов, имеющихся в растворе. Обозначается молярная доля буквой N.
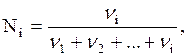
где Ni — молярная доля i -го компонента;
n1, n2, ni — число молей каждого компонента.
Пример
Вычислить молярную долю хлорида лития в растворе, состоящем из 100 г Н2О и 30 г LiCl.
Решение
Находим число молей каждого компонента:
моль LiCl равен 42,5 г/моль;
число молей LiCl 30/42,5 » 0,7;
моль Н2О равен 18 г/моль;
число молей Н2О 100/18 = 5,5.
Молярная доля LiCl равна:
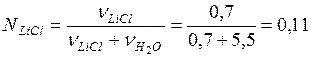 .
.
Эквивалентная (нормальная) концентрация
Эквивалентная или нормальная концентрация (СН.) показывает число эквивалентных масс растворенного вещества, содержащихся в 1литре раствора. Для обозначения нормальной концентрации пользуются буквой н. Так, 1 н. НСl означает раствор, в 1 л которого содержится одна эквивалентная масса НСl.
Растворы, содержащие 2, 3 и т.д. эквивалентные массы, называются двунормальными, трехнормальными и т.д., а содержащие доли эквивалентных масс, например, 0,1; 0,02; 0,001, называются соответственно децинормальными (0,1н.), двусантинормальными (0,02н.), миллинормальными (0,001 н.).
Пример
Вычислить нормальность раствора серной кислоты, в 250 мл которого содержится 10 г Н2SО4.
Решение
Находим массу Н2SО4 в 1 л раствора:
250 мл р-ра — 10 г Н2SО4
1000 мл р-ра — х
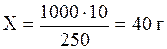 .
.
Эквивалентная масса Н2SО4 равна:
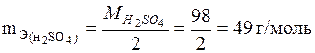 .
.
Число эквивалентных масс, содержащихся в 40 г:
40/49 @ 0,8.
Следовательно, раствор является 0,8 н.
Титр раствора
Под титром понимают число граммов растворенного вещества, содержащееся в 1 мл раствора. Титр обозначают буквой Т с указанием формулы соответствующего вещества. Например, выражение ТН2SО4=0,0049 г/мл означает, что каждый миллилитр данного раствора серной кислоты содержит 0,0049 г Н2SО4.
Титр можно рассчитать: по формуле 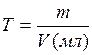 или если известна нормальность раствора:
или если известна нормальность раствора:
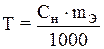 ,
,
где СН. — нормальная концентрация раствора;
mэ — эквивалентная масса растворенного вещества.
Пример
Вычислить титр 0,1 н. раствора Nа2СО3.
Решение
Находим эквивалентную массу Nа2СО3
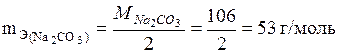 ;
;
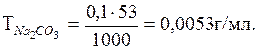
Закон эквивалентов для растворов
Пользуясь растворами, концентрация которых выражена нормальностью, легко рассчитать, в каких объемных отношениях они должны быть смешаны, чтобы растворенные вещества прореагировали без остатка. Пусть объем V1 литров раствора вещества “1” с нормальной концентрацией СН1 реагирует с объемом V2 литров раствора вещества “2” с нормальной концентрацией СН2. Это значит, что в реакцию вступило (СН1×V1) эквивалентов вещества “1” и (СН2×V2) эквивалентов вещества “2”. Так как вещества реагируют в эквивалентных количествах, следовательно:
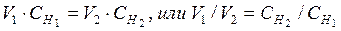 .
.
Таким образом, объемы растворов реагирующих веществ обратно пропорциональны их нормальным концентрациям (закон эквивалентов для растворов).
Пример
Сколько миллилитров 0,12 н. раствора хлорида натрия надо прибавить к 15 мл 0,25 н. раствора нитрата серебра, чтобы осадить все находящееся в растворе серебро в виде хлорида серебра?
Решение
Согласно закону эквивалентов для растворов
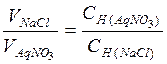 , откуда
, откуда
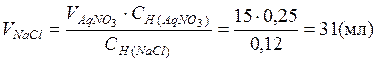 .
.
Экспериментальная часть
Цель работы: знакомство с основными способами выражения концентрации и методами ее определения.
Опыт № 1
Приготовление 5%-ного раствора дихромата калия
Рассчитайте массу дихромата калия К2Сr2О7, необходимую для приготовления 50 г 5%-ного раствора; вычисленную массу взвесьте на техно-химических весах на часовом стекле (с точностью до 0,01 г). Отмерьте мерным цилиндром необходимый объем дистиллированной воды. Навеску дихромата калия перенесите в стакан емкостью 100 мл, обмойте стекло над стаканом небольшим количеством воды из цилиндра и оставшуюся воду также перелейте в стакан. Смесь перемешайте стеклянной палочкой до полного растворения кристаллов соли. Полученный раствор налейте в цилиндр емкостью 50 мл до 4/5 его объема и определите плотность раствора ареометром. По плотности найдите массовый процент полученного раствора (см.приложение, таблица 2), рассчитайте абсолютную и относительную ошибки измерений. Все расчеты запишите в лабораторный журнал.
Опыт № 2
Дата добавления: 2019-09-13; просмотров: 418; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
