Взаимодействие основного оксида с водой
Небольшое количество оксида магния взбалтывают в пробирке с водой. Прибавляют в жидкость спиртового раствора фенолфталеина. Наблюдать изменение окраски индикатора, написать уравнение реакции.
Опыт № 4
Получение гидроксидов кобальта и хрома
В одну пробирку прилить 5–10 капель 2н раствора хлорида кобальта (II), в другую столько же 2н раствора сульфата хрома. В обе пробирки добавить равное количество раствора щелочи. Наблюдать появление осадков и отметить их цвет. Написать уравнения реакций. Осадки оставить для опыта 5.
Опыт № 5
Изучение свойств основного и амфотерного гидроксидов
Полученные в опыте 4 осадка разделить на 2 части. К одной из них добавить раствор HCl, к другой части – раствор щелочи NaOH (избыток). В каких случаях растворился осадок? Написать уравнения реакций.
Опыт № 6
Взаимодействие солей с металлами
Опустить в раствор сульфата меди железный гвоздь и наблюдать на нем появление налета. Написать уравнение реакции.
Опыт № 7
Взаимодействие кислоты с солью
К раствору нитрата серебра добавить раствор соляной кислоты. Наблюдать появление осадка. Написать уравнение реакции.
Опыт № 8
Взаимодействие кислоты со щелочью
(реакция нейтрализации)
В фарфоровую чашку налить 1 мл 2н раствора гидроксида натрия и 1–2 капли фенолфталеина, и прибавлять по каплям 2н раствор соляной кислоты до исчезновения малиновой окраски. Написать уравнение реакции.
|
|
|
Опыт № 9
Получение кислой соли
В пробирку, снабженную газоотводной трубкой, поместить карбонат кальция и прилить 2н раствор соляной кислоты. Выделившийся газ пропускать через раствор гидроксида кальция. Наблюдать образование осадка нормальной соли и дальнейшее растворение осадка вследствие образования кислой соли. Составить уравнение реакции.
Опыт № 10
Образование основной соли
К 2н раствору сульфата меди по каплям прибавлять 10%-ный раствор аммиака до образования осадка основной соли. Составить уравнение реакции.
Контрольные вопросы
1. Что такое простые и сложные вещества? Почему число простых веществ больше числа химических элементов?
2. Назовите важнейшие классы сложных неорганических веществ. Приведите примеры каждого класса.
3. Что такое оксиды? Как они называются? Приведите примеры
4. Что такое солеобразующие и несолеобразующие оксиды? Приведите примеры.
5. На какие типы делятся солеобразующие оксиды? Приведите примеры.
6. Что такое основания? На какие типы они делятся? Приведите примеры и назовите каждое соединение.
7. Что определяет кислотность основания? Что называется щелочами?
8. Что такое кислоты? Классификация кислот. Как строятся названия кислот?
|
|
|
9. Что такое кислотный остаток? Чем определяется его валентность?
10. Что такое основность кислоты? Как она определяется?
11. Что такое соли? На какие типы они делятся?
12. Какие соли относят к средним, кислым, основным? Приведите примеры каждого типа солей и назовите их.
Лабораторная работа № 2
ОПРЕДЕЛЕНИЕ ЭКВИВАЛЕНТНОЙ МАССЫ МЕТАЛЛА
Теоретическая часть
Эквивалентом называется количество вещества (в молях), которое соединяется с 1молем атомов водорода или замещает 1моль атомов водорода в химических реакциях.
Например, эквиваленты хлора в соляной кислоте НСl, кислорода в воде Н2О и азота в аммиаке NН3 соответственно равны 1 молю, 0,5 моля и 1/3 моля, т.к. на 1моль атомов водорода в этих соединениях приходится 1моль атомов хлора, 1/2 моля атомов кислорода и 1/3 моля атомов азота.
Эквивалентной массой ( m Э ) называется масса 1 эквивалента, выраженная в г/моль или кг/моль. Так, эквивалентная масса водорода  ,
,  . Эквивалентные массы элементов определяют, исходя из молярных масс атомов:
. Эквивалентные массы элементов определяют, исходя из молярных масс атомов:
 = 35,5 г/моль,
= 35,5 г/моль,
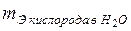 = 16/2 = 8г/моль,
= 16/2 = 8г/моль,
 = 14/3 = 4,67г/моль.
= 14/3 = 4,67г/моль.
Между эквивалентной массой элемента (mЭ), молярной массой его атомов (М) и валентностью (B) существует зависимость:
|
|
|
m Э = M/ B ,(1)
из которой следует, что элемент, проявляющий в соединениях переменную валентность, имеет несколько значений эквивалентных масс.
Например, эквивалентные массы азота mЭ(N) в NН3, NО, NО2 будут:
в аммиаке  = 14/3 = 4,67 (г/моль),
= 14/3 = 4,67 (г/моль),
в монооксиде азота  = 14/2 = 7 (г/моль),
= 14/2 = 7 (г/моль),
в диоксиде азота  = 14/4 = 3,5 (г/моль).
= 14/4 = 3,5 (г/моль).
Понятие об эквивалентных массах распространяется и на химические соединения: оксиды, основания, кислоты и соли.
Эквивалентная масса оксида равна сумме эквивалентных масс элемента, образовавшего оксид, и кислорода.
Например, эквивалентная масса воды Н2О равна сумме эквивалентных масс водорода и кислорода:
 = 1 + 8 = 9 (г/моль),
= 1 + 8 = 9 (г/моль),
 = 27/3 + 8 = 17 (г/моль).
= 27/3 + 8 = 17 (г/моль).
Эквивалентную массу оксида можно определить также по формуле:
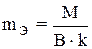 ,
,
где М — молярная масса оксида;
B — валентность элемента, образовавшего оксид;
к — число атомов элемента, образовавшего оксид, например:
 ,
,
 .
.
Эквивалентную массу основания находят делением его молярной массы на валентность металла, или, что то же самое, на кислотность основания, т.е. на число ионов 


m Э основания = М основания/кислотность основания, например, эквивалентная масса гидроксида калия равна его молярной массе:
|
|
|
 .
.
Эквивалентная масса гидроксида кальция Са(ОН)2 равна половине его молярной массы:

Эквивалентную массу кислоты определяют как частное от деления ее молярной массы на основность кислоты:
m Э кислоты = М кислоты/основность кислоты.
Под основностью кислоты понимают количество атомов водорода, замещающихся на металл в результате реакции. Поэтому эквивалентные массы одноосновных кислот (НСl, НВr, НNО3, СН3СООН) равны их молярным массам. Например:

Эквивалентные массы двухосновных или трехосновных кислот равны соответственно 1/2 или 1/3 их молярных масс.
 =
=  /2 = 98/2 = 49 (г/моль),
/2 = 98/2 = 49 (г/моль),
 =
=  /3 = 98/3 = 32,7 (г/моль).
/3 = 98/3 = 32,7 (г/моль).
Эквивалентная масса соли может быть вычислена как частное от деления ее молярной массы на произведение числа атомов металла и его валентности:
m Э соли = М соли/число атомов металла × валентность металла.
Например, эквивалентная масса сульфата алюминия:
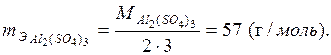
Все расчеты, связанные с определением эквивалентных масс элементов, проводят на основании закона эквивалентов, согласно которому: элементы соединяются друг с другом и замещают один другого в соединениях в количествах, пропорциональных их эквивалентным массам.
Математическое выражение закона эквивалентов следующее:
 , (2)
, (2)
где m1 и m2 — массы реагирующих веществ, г;
 — их эквивалентные массы, г/моль.
— их эквивалентные массы, г/моль.
Согласно закону эквивалентов элементы взаимодействуют друг с другом равным числом эквивалентных масс (n):n1=n2
Рассмотрим некоторые методы экспериментального определения эквивалентных масс.
Метод прямого определения.
Эквивалентная масса определяется из данных прямого синтеза водородного или кислородного соединений данного элемента. При этом используются значения эквивалентных масс водорода (  = 1г/моль) и кислорода (
= 1г/моль) и кислорода (  = 8 г/моль).
= 8 г/моль).
Пример
При окислении 0,253 г магния получено 0,420 г его оксида. Чему равна эквивалентная масса магния?
Решение
Масса поглощенного кислорода в соответствии с законом сохранения массы равна:
 = 0,420 — 0,253 = 0,167 (г).
= 0,420 — 0,253 = 0,167 (г).
По закону эквивалентов вычисляем эквивалентную массу магния:
 ;
;
 .
.
Аналитический метод.
Производится точный анализ соединения данного элемента с любым другим, эквивалентная масса которого известна, и по составу соединения вычисляется его эквивалентная масса.
Пример
Анализом хлорида серебра установлено, что он содержит 75,26% серебра. Определить эквивалентную массу хлора, если известно, что эквивалентная масса серебра равна 107,87 г/моль.
Решение
Рассчитываем процентное содержание хлора:
%Сl = (100—75,26) = 24,74%.
Затем по закону эквивалентов находим эквивалентную массу Сl.

 .
.
Электрохимический метод.
Определяется масса вещества, осаждающегося на электроде при электролизе соли. Эквивалентную массу рассчитывают по следствию из закона Фарадея: при прохождении через раствор электролита 96500 кулонов электричества на электродах выделяется 1 эквивалентная масса вещества.
Пример
При пропускании электрического тока силой 2А в течение 2412с через раствор нитрата серебра на катоде выделилось 5,4 г серебра. Чему равна эквивалентная масса серебра?
Решение
Известно, что при прохождении (2А×2412с) = 4824 Кл электричества выделяется 5,4 г серебра, поэтому:
4824 Кл — 5,4 г
96500 Кл — х г
 ,
,
т.е. эквивалентная масса серебра равна 108 г/моль.
Метод вытеснения водорода.
Этот метод используют для определения эквивалентных масс металлов, которые способны вытеснять водород из разбавленных кислот и щелочей. Эквивалентная масса определяется из отношения массы данного элемента к массе или, чаще всего, к объему вытесненного водорода. При этом целесообразно пользоваться значением эквивалентного объема водорода.
Эквивалентным объемом (VЭ) называется объем, занимаемый при данных условиях одной эквивалентной массой газообразного вещества.
Поскольку моль любого газа при нормальных условиях (н.у.) занимает объем 22,4 л (следствие из закона Авогадро), эквивалентный объем водорода можно найти из пропорции:
М – V м
m э – V э
2г Н2 (1 моль) — 22,4 л
1г Н2 (1 экв.масса) — х л
 ,
,
Аналогично находят эквивалентный объем кислорода:
32 г О2 (1 моль) — 22,4 л
8г О2 (1 экв.масса) — х л
 ,
,
Пример
При взаимодействии 0,0936 г двухвалентного металла с соляной кислотой выделилось 37,3 мл водорода, измеренного при н.у. Чему равна эквивалентная масса металла? Что это за металл?
Решение
Для реакции взаимодействия металла с разбавленной соляной кислотой по уравнению:
 ,
,
математическое выражение закона эквивалентов запишется:
 , или
, или  .
.
Так как количество водорода удобнее измерять в объемных единицах, а объем газа при постоянных температуре и давлении прямо пропорционален его массе, отношение  можно заменить равным ему отношением
можно заменить равным ему отношением  В результате получим выражение:
В результате получим выражение: 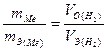 , (3)
, (3)
где:  — объем вытесненного водорода, а
— объем вытесненного водорода, а
 — эквивалентный объем водорода, измеренные при нормальных условиях, т.е. при t = 00С(T = 273 К) и Р = 760 мм рт.ст. (1атм. или 101325 Па). Откуда:
— эквивалентный объем водорода, измеренные при нормальных условиях, т.е. при t = 00С(T = 273 К) и Р = 760 мм рт.ст. (1атм. или 101325 Па). Откуда:

Из уравнения mЭ= М/В находим молярную массу атомов металла (M):
M = mЭ(Me)×В = 28×2 = 56 (г/моль).
По таблице Д.И.Менделеева определяем, что этот металл — Fе.
Экспериментальная часть
Цель работы: пользуясь методом вытеснения водорода, определить эквивалентную массу металла, рассчитать молярную массу его атомов и установить, какой это металл.

Рис. 1 . Прибор для определения эквивалентной массы металла
Прибор для определения эквивалентной массы металла (рис.1) состоит из двух сообщающихся бюреток Б1 и Б2, наполовину заполненных водой. К одной из бюреток присоединена пробирка П. Прежде, чем приступить к эксперименту, убедитесь в герметичности прибора. Для этого, проверив, плотно ли закрыты отверстия О1 и О2, поднимите или опустите бюретку Б2 на 10–20 см и, закрепив ее в таком положении, наблюдайте в течение 2–3 минут за уровнем воды в бюретке Б1. Вначале уровень воды в бюретке несколько понизится (или повысится), а затем, если прибор герметичен, останется без изменения.
Проведение эксперимента
В пробирку П налейте с помощью стаканчика 5–6 мл 10%-ного раствора соляной кислоты. Получите у преподавателя навеску металла, взвешенную на аналитических весах и помещенную в пакетик из папиросной бумаги. Запишите массу металла в таблицу1. Пакетик откройте с одной стороны, смочите его водой, приложите к внутренней части пробирки и продвиньте при помощи стеклянной палочки как можно ближе к поверхности кислоты (расстояние от нижней части пакетика до поверхности кислоты ~ 1 см).
Пробирку установите на место и вновь проверьте герметичность прибора. Закрепите бюретки таким образом, чтобы уровень воды в них был точно на одной линии. Отметьте и запишите в таблицу положение воды (по нижней части мениска) в бюретке Б1. Немного приподняв нижнюю часть пробирки, приведите в соприкосновение металл с кислотой. Наблюдайте выделение водорода и вытеснение воды из бюретки Б1 в бюретку Б2. Когда весь металл прореагирует, дайте пробирке остыть (3–5 мин.) и вновь приведите воду в бюретках Б1 и Б2 к одному уровню, т.е. создайте в бюретке Б1 давление, равное атмосферному. Точно отметьте и запишите в таблицу положение мениска воды в бюретке Б1 после опыта. Разность уровней воды в бюретке Б1 до и после реакции металла с соляной кислотой равна объему выделившегося водорода. Занесите в таблицу показания барометра и термометра. Приведите с помощью уравнения Клапейрона объем вытесненного водорода к нормальным условиям.
 (4).
(4).
При этом необходимо учесть, что водород, собранный над водой, содержит водяной пар и что общее давление газа, равное атмосферному, складывается из парциальных давлений водорода и водяного пара, т.е.:
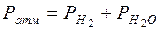 , откуда:
, откуда:
 ,
,
где РН2 — парциальное давление водорода, собранного над водой, мм рт.ст.;
Ратм — атмосферное давление, мм рт.ст.;
 — давление насыщенного водяного пара при температуре опыта, мм рт.ст. (см.таблицу 1 приложения).
— давление насыщенного водяного пара при температуре опыта, мм рт.ст. (см.таблицу 1 приложения).
Объем водорода, приведенный к нормальным условиям, будет равен:
 , (5)
, (5)
или после подстановки в уравнение известных постоянных величин:
 , (6)
, (6)
где V — объем выделившегося водорода при условиях опыта, мл;
t — температура опыта, ОС.
Эквивалентную массу металла определите по формуле:
 ;
;  .
.
Зная валентность металла (сообщается преподавателем), найдите приближенное значение молярной массы атомов металла (М) и определите, что это за металл. Затем, воспользовавшись уравнением (1), рассчитайте теоретическое значение эквивалентной массы металла.
Вычислите абсолютную (D) и относительную (d) ошибки опыта.
 ,
,
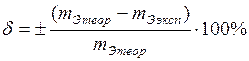 .
.
Результаты измерений занесите в таблицу 1.
Таблица 1.
| Навеска металла, г | |||
| Температура, 0С | |||
| Атмосферное давление, мм рт.ст. | |||
| Давление насыщ. водяного пара при tо опыта, мм рт.ст | |||
| Парциальное давление водорода, мм рт.ст. | |||
| Положение мениска воды | До реакции | ||
| в бюретке Б1, мл | После реакции | ||
| Объем вытесненного водорода при условиях опыта, мл | |||
| Объем водорода, приведен.к нормальным условиям, мл | |||
| Эквивалентная масса металла (эксперим.значение), г/моль | |||
| Валентность металла | |||
| Название металла | |||
| Эквивалентная масса металла (теоретич.значение), г/моль | |||
| Ошибка | Абсолютная, г/моль | ||
| опыта | Относительная, % | ||
Контрольные вопросы
1. Что называется химическим эквивалентом элемента?
2. Что такое эквивалентная масса?
3. Чему равны эквивалентные массы элемента, оксида, основания, кислоты, соли? Рассчитать эквивалентные массы: Al, Al2О3, Al(ОН)3, Н2SO4, Аl2(SO4)3.
4. Чему равен эквивалентный объем водорода, кислорода, хлора при нормальных условиях?
5. Как привести объем газа к нормальным условиям?
6. Сформулируйте закон эквивалентов.
7. Запишите математическое выражение закона эквивалентов и преобразуйте его для случая взаимодействия металла с кислотой.
Лабораторная работа № 3
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Теоретическая часть
 Как известно, ковалентная химическая связь между атомами образуется за счет неспаренных электронов с антипараллельными спинами каждого атома, которые связываются в пару электронов, являющуюся общей для обоих атомов:
Как известно, ковалентная химическая связь между атомами образуется за счет неспаренных электронов с антипараллельными спинами каждого атома, которые связываются в пару электронов, являющуюся общей для обоих атомов:
А + В ¯ = А ¯ В
Механизм возникновения связи путем обобществления неспаренных электронов двух атомов получил название обменного механизма.
 Однако возможен и другой механизм образования ковалентной связи – донорно-акцепторный. В этом случае химическая связь возникает за счет неподеленных электронных пар одного из атомов (донора) и свободных орбиталей другого (акцептора):
Однако возможен и другой механизм образования ковалентной связи – донорно-акцепторный. В этом случае химическая связь возникает за счет неподеленных электронных пар одного из атомов (донора) и свободных орбиталей другого (акцептора):
А ¯ + В = А ¯ В
Рассмотрим образование химической связи по донорно-акцепторному механизму при взаимодействии молекулы аммиака с ионом водорода. Атом азота имеет на внешнем энергетическом уровне два спаренных и три неспаренных электрона:
 2s 2р
2s 2р
¯
В молекуле аммиака неспаренные 2р-электроны атома азота образуют три электронные пары с электронами атомов водорода. У атома азота остается неподеленная пара электронов 2s2, т.е. два электрона с антипараллельными спинами на одной атомной орбитали. Атомная орбиталь иона водорода не содержит электронов (вакантная орбиталь). При сближении молекулы аммиака и иона водорода происходит взаимодействие неподеленной пары электронов атома азота и вакантной орбитали иона водорода. Неподеленная пара электронов становится общей для атомов азота и водорода, возникает химическая связь по донорно-акцепторному механизму. Атом азота молекулы аммиака является донором, а ион водорода — акцептором. Обозначив неподеленную пару электронов двумя точками, вакантную орбиталь квадратом, а связи черточками, можно представить образование иона аммония следующей схемой:
Н Н +
ç ç
Н — N : + Н+ = Н — N®Н
ç ç
 Н Н
Н Н
Важно отметить, что связи Н — N, образованные по различным механизмам, никаких различий в свойствах (например, в энергии связи, дипольных моментах связи и т.д.) не имеют, т.е. независимо от механизма образования возникающие ковалентные связи равноценны.
Соединения, в которых действует одна или несколько донорно-акцепторных связей, называются комплексными. В комплексных соединениях различают внутреннюю и внешнюю сферы. Внутренняя сфера заключается в квадратные скобки и состоит из комплексообразователя и лигандов. Комплексообразователь — центральный атом или ион, являющийся акцептором электронов. Лиганды — это ионы или молекулы, связанные с комплексообразователем донорно-акцепторной связью, и являющиеся донорами электронов.
 внутренняя внешняя
внутренняя внешняя
сфера сфера
 Сl3
Сl3
комплексо- лиганды
образователь
Комплексообразователями могут быть:
1) ионы металлов (d-элементы, имеющие большое число свободных орбиталей): Рb2+, Сu2+, Рt4+, Сr3+, Аg+ и т.д.;
2) неметаллы в положительной степени окисления:
 и др.;
и др.;
3) нейтральные атомы d - металлов: Сr, Fе, Мn, Мо и др.
В качестве лигандов могут быть:
1) отрицательные ионы Сl—, I—, Вr —, СN—, ОН—, SCN—, SO42¯,
NО2 — и др.;
2) полярные молекулы Н2О, NН3, СО, NО, РН3 и др.
Количество лигандов, присоединенных к комплексообразователю, называется координационным числом (К.Ч.) Это число может принимать значения от 1 до 12, но чаще 2,4 и 6, что соответствует наиболее устойчивым геометрически симметричным конфигурациям комплексов.

К.Ч. = 2 К.Ч. = 6 К.Ч. = 4
Значение координационного числа зависит от природы комплексообразователя и лигандов, а также от их размеров.
Комплексные соединения классифицируются по характеру электрического заряда комплексного иона:
1) катионные  ;
;
2) анионные  ;
;
3) нейтральные  .
.
Электрический заряд комплексного иона (W) равен сумме зарядов комплексообразователя и лигандов (заряды лигандов-нейтральных молекул равны нулю):
 ,
,
где ZК — заряд комплексообразователя;
ZЛ — заряд лиганда.
Например, в комплексном ионе  заряд комплексообразователя Fе3+ — плюс три, а заряд лиганда СN- — минус единица. Тогда заряд комплексного иона равен:
заряд комплексообразователя Fе3+ — плюс три, а заряд лиганда СN- — минус единица. Тогда заряд комплексного иона равен:
 , т.е.
, т.е.  .
.
Комплекные соединения, содержащие во внешней сфере ионы того или иного знака, являются сильными электролитами и их растворы подчиняются тем же законам, что и растворы неорганических соединений. Они могут быть основаниями, кислотами и солями: 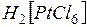 кислота,
кислота,  соль,
соль,  —основание.
—основание.
В водных растворах комплексные соединения диссоциируют на ионы внешней и внутреней сферы. Например:
 .
.
Комплексные ионы, хотя и незначительно, могут диссоциировать на комплексообразователь и лиганды:
 .
.
Процесс диссоциации подчиняется закону действующих масс и может быть охарактеризован константой диссоциации:
 .
.
Эта константа фактически характеризует прочность комплексного иона и называется константой нестойкости (Кнест.). Чем больше Кнест., тем меньше прочность комплексного иона. Так, из двух комплексных ионов 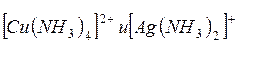 , имеющих константы нестойкости
, имеющих константы нестойкости  соответственно, аммиачный комплекс меди более прочен.
соответственно, аммиачный комплекс меди более прочен.
Экспериментальная часть
Цель работы: знакомство с классом комплексных соединений, их поведением в водных растворах и некоторыми характерными реакциями.
Опыт № 1
Дата добавления: 2019-09-13; просмотров: 280; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
