Получение основного, кислотного оксида, кислоты
Министерство образования Республики Беларусь
Учреждение образования «Гомельский государственный
технический университет имени П.О. Сухого»
Кафедра «Материаловедение в машиностроении»
Давыдова О.В.
ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ
Практикум по выполнению лабораторных работ
Для студентов очной формы обучения
Для специальности
Производство изделий на основе трехмерных технологий»
Гомель 2019
УДК 54
ББК 24
Рекомендовано к изданию научно-методическим советом
механико-технологического факультета ГГТУ им. П.О. Сухого
(протокол №3 от 07.03.2019 г.)
Автор-составитель:
О .В. Давыдова, старший преподаватель кафедры
«Материаловедение в машиностроении», ГГТУ им. П.О. Сухого
Рецензент: зав. каф. «Металлургия и технология обработки
материалов» ГГТУ им. П.О. Сухого, к.т.н., доцент Ю.Л. Бобарикин
Изложены основные теоретические сведения по важнейшим разделам курса общей и неорганической химии. Рассмотрена методика выполнения лабораторных работ. Рекомендован порядок их выполнения и составления отчетов. Для студентов специальности «Производство изделий на основе трехмерных технологий»
ВВЕДЕНИЕ
Химия, являясь одной из фундаментальных естественнонаучных дисциплин, изучает материальный мир, законы его развития, химическую форму движения материи. Знание химии необходимо для плодотворной творческой деятельности инженера любой специальности. Изучение химии позволяет получить современное научное представление о материи и формах ее движения, о веществе как одном из видов движущейся материи, о механизме превращения химических соединений, о свойствах технических материалов и применении химических процессов в современной технике. Необходимо прочно усвоить основные законы и теории химии, овладеть техникой химических расчетов, выработать навыки самостоятельного выполнения химических экспериментов и обобщения наблюдаемых фактов. Знание химии необходимо для успешного последующего изучения общенаучных и специальных дисциплин.
|
|
|
Практикум включает лабораторные работы по важнейшим разделам курса общей и неорганической химии, в которых представлена методика выполнения лабораторных работ, сведения об используемых процессах и приборах, рекомендован порядок выполнения лабораторных работ и составления отчетов.
Лабораторный практикум составлен в соответствии с учебной программой дисциплины «Общая и неорганическая химия». Для студентов специальности «Производство изделий на основе трехмерных технологий».
Лабораторная работа № 1
|
|
|
ОСНОВНЫЕ КЛАССЫ НЕОГРАНИЧЕСКИХ СОЕДИНЕНИЙ
Теоретическая часть
Все вещества делятся на простые и сложные.
Простыми называются вещества, состоящие из атомов одного элемента, сложными – состоящие из атомов двух и более элементов.
Простые вещества подразделяются на металлы и неметаллы. К последним обычно относят (H, B, C, N, O, F, Si, P, S, Cl, As, Se, Br, Te, I, At, He, Ne, Ar, Kr, Xe и Rn (всего 22)). Остальные элементы условно считаются металлами.
Сложные вещества делятся на неорганические и органические.
Важнейшими классами сложных неорганических веществ являются: оксиды, кислоты, основания, соли, а также галогениды, халькогениды, нитриды, фосфиды, карбиды, гидриды.
Оксиды – это соединения двух элементов, один из которых кислород. Общая формула оксидов: 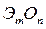 ;
;
где m – число атомов элемента Э; n – число атомов кислорода;
Например: PbO2 – оксид свинца (IV), Cu2O – оксид меди (I)
Оксиды делятся на:
А) несолеобразующие – не образуют солей при взаимодействии с кислотами и основаниями (CO, NO, N2O).
Б) солеобразующие
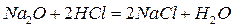
Эти оксиды, как правило, реагируют с водой, образуя гидраты оксидов (гидроксиды)
Они делятся на:
1) Основные оксиды – их гидраты – основания.
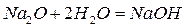
2) Кислотные оксиды – их гидраты – кислоты.
|
|
|
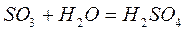
3) Амфотерные оксиды – это оксиды, которые проявляют как основные, так и кислотные свойства – им соответствуют амфотерные гидроксиды (Be, Zn, Al, Sn, Pb).
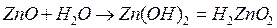
| Взаимодействие оксидов | Оксиды | ||
| Основные Na2O, CaO, MgO, CuO, Fe2O3, ВаО | Кислотные SO2, SO3, P2O5, CO2, Cl2O, Mn2O7, CrO3 | Амфотерные ВеО, ZnO, PbO SnO, Al2O3, Cr2O3 | |
| С водой | Реагируют только оксиды ЩМ и ЩЗМ, образуя щелочи: Na2O + H2O = 2NaOH | Образуют кислоты: SO3 + H2O = H2SO4 | Не взаимодействуют |
| С кислотами или основаниями | Взаимодействуют с Кислотами с образованием соли и воды: CаO + 2HCl = CаCl2 + H2O | Взаимодействуют с основаниями с образованием соли и воды: CO2 + Ba(OH)2= BaCO3 + H2O | Взаимодействуют с кислотами как основные оксиды: BeO + 2HNO3 = Be(NO3)2 + H2O. И с основаниями как кислотные оксиды: BeO + 2KOH = K2BeO2+ H2O |
| Между собой | При взаимодействии основного и кислотного оксидов образуется соль: Na2O + SO3= Na2SO4 | ||
Одним из способов получения оксидов является взаимодействие простых веществ с кислородом: 2Са + O2= 2СаO;
С + O2= СО2.
Галогениды – это соединения галогенов (фтор, хлор, бром и йод) с менее электроотрицательными элементами. (Электроотрицательность ЭО – это способность данного атома оттягивать на себя электроны от других атомов при образовании химических связей. Чем больше ЭО, тем больше эта способность.)
|
|
|
NaF – фторид натрия. OF2 – дифторид кислорода.
Халькогениды – это соединения элементов VI A группы (сера, селен и теллур) с менее электроотрицательными элементами.
CuS – сульфид меди; CS2 – дисульфид углерода (сероуглерод).
Нитриды – это бинарные соединения азота с менее электроотрицательными элементами.
BN – мононитрид бора; V3N – нитрид триванадия.
Фосфиды – ими являются бинарные соединения фосфора с менее электроотрицательными атомами.
Fe3P – фосфид трижелеза; K3P – фосфид трикалия (фосфид калия).
Карбиды – к карбидам относятся соединения углерода с менее электроотрицательными элементами.
CaC2 – дикарбид кальция; SiC – карбид кремния.
Гидриды – это соединения водорода с металлами и неметаллами, менее электроотрицательными, чем водород.
CaH2 – гидрид кальция; FeH2 – дигидрид железа, AsH3 – гидрид мышьяка.
Основания – это сложные вещества, молекулы которых состоят из атомов металла и одной или нескольких гидроксидных групп (OH). Общая формула основания:
Me(OH)Y ,
где Y – число гидроксидных групп, равное валентности металла Me .
Например: NaOH , Ca ( OH )2, Al ( OH )3 .
Основания взаимодействуют:
1. С кислотами с образованием соли и воды
2NaOH + H2SO4= Na2SO4+ 2H2O.
2. С кислотными и амфотерными оксидами с образованием соли и воды
2KOH + N2O5= 2KNO3+ H2O;
2NaOH + Al2O3= 2NaAlO2+ H2O.
3. С солями с образованием новой соли и нового основания
2NaOH + MgCl2= Mg(OH)2↓ + 2NaCl.
Растворимые в воде основания (щелочи) получают взаимодействием активных металлов или их оксидов с водой:
2Na + 2H2O = 2NaOH + H2↑;
BaO + H2O = Ba(OH)2.
Нерастворимые в воде основания получают реакцией обмена:
Fe2(SO4)3+ 6KOH = 2Fe(OH)3↓ + 3K2SO4.
Кислоты – это сложные вещества, содержащие атомы водорода, которые могут замещаться атомами металла. Общая формула кислот:
HX(Ac),
где Ac – кислотный остаток (от англ. acid – кислота);
Х – число атомов водорода, равное валентности кислотного остатка.
Например: HCl , HNO 3 , H 2 SO 4 и др.
Кислоты взаимодействуют:
1. С основаниями с образованием соли и воды
2HNO3+ Ca(OH)2= Ca(NO3)2+ 2H2O.
2. С основными и амфотерными оксидами с образованием соли и воды
2HCl + ВаO = ВаCl2+ H2O;
3H2SO4+ Al2O3= Al2(SO4)3+ 3H2O.
3. С солями с образованием новой соли и новой кислоты
H2SO4+ Ba(NO3)2= BaSO4↓ + 2HNO3.
Одним из способов получения кислот является взаимодействие кислотного оксида с водой:
P2O5+ 3H2O = 2H3PO4.
Соли – это продукты замещения атомов водорода в молекулах кислот атомами металла или это продукты замещения гидроксидных групп в молекулах оснований кислотными остатками.
Например: NaCl, CaSO4, Na3PO4 и др.
Средние соли (К2SO4, Na3PO4) –это продукты полного замещения водорода в кислоте на металл или гидроксогрупп в основании на кислотный остаток: H2SO4+ 2KOH = K2SO4+ 2H2O;
Mg(ОН)2+ 2HCl = MgCl2+ 2Н2О.
Молекулы средних солей содержат только катионы металла и анионы кислотного остатка: NaCl, Al2(SO4)3, K2CO3.
Кислые соли (Сa(HCO3)2, Nа2НРО4) –это продукты неполного замещения водорода в кислоте на металл:
KOH + H2SO4 = KHSO4+ H2O
В молекулах кислых солей содержатся атомы водорода:Ca(H2PO4)2, Al(HCO3)3. В название кислой соли добавляется приставка “гидро”: NaHCO3– гидрокарбонат натрия, FeH2PO4– дигидрофосфат железа (III).
Кислые соли образуют только многоосновные кислоты (H2SO4, Н3РО4, Н2СО3, H2S).
Основные соли (СuOHNO3, FeOHCl2) – это продукты неполного замещения гидроксогрупп в основании на кислотный остаток:
Mg(ОН)2 + HCl = MgOHCl + Н2О.
Основные соли образуют только многокислотные основания (Сu(OH)2, Fe(OH)3, Mg(ОН)2). В молекулах основных солей содержатся гидроксогруппы: CuOHCl, Zn(OH)NO3. В названии основных солей присутствует приставка “гидроксо”: AlOHSO4– сульфат гидроксоалюминия, CuOHCl – хлорид гидроксомеди.
Экспериментальная часть
Цель работы: изучить классы неорганических соединений, научиться составлять уравнения реакций.
Опыт № 1
Получение основного, кислотного оксида, кислоты
В сухую пробирку насыпать немного гидроксокарбоната меди, закрыть ее газоотводной трубкой. Во вторую пробирку налить дистиллированной воды и 2–4 капли нейтрального раствора лакмуса. Газоотводную трубку опустить в воду. Осторожно нагревать пробирку до появления черного осадка основного оксида. Наблюдать изменение окраски лакмуса вследствие взаимодействия кислотного оксида с водой с образованием кислоты.
Составить уравнения реакций разложения основной соли, образования кислоты.
Осадок в пробирке оставить для следующего опыта.
Опыт № 2
Получение средней соли
К полученному осадку в пробирке прибавить 2н раствор серной кислоты до растворения осадка. Наблюдать появление характерного для данной соли окрашивания. Составить уравнение реакции.
Опыт № 3
Дата добавления: 2019-09-13; просмотров: 317; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
