ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Теоретическая часть
Все многообразие реакций можно разделить на две группы:
1) реакции, протекающие без изменения степени окисления реагирующих веществ.
К ним относятся:
а) реакции обмена:
 ;
;
б) некоторые реакции соединения и разложения:

 ;
;
2) реакции, сопровождающиеся изменением степени окисления элементов, входящих в состав реагирующих веществ:
а) реакции замещения:
 ;
;
б) некоторые реакции соединения и разложения:
 ;
;
 .
.
Окислительно-восстановительными реакциями (ОВР) называют такие реакции, в которых изменяются степени окисления реагирующих веществ.
При изучении химических реакций необходимо различать понятия “валентность элемента” и “степень окисления” его атома.
Валентностью элемента называют свойство его атомов присоединять или замещать определенное число атомов другого элемента. Валентность атома определяют числом всех его связей с другими атомами. Например, в соединениях HCl и HClO валентность хлора равна единице(H–Cl, H–O–Cl).
Степень окисления атома в молекуле –это условный электрический заряд, вызванный смещением валентных электронов к более электроотрицательному атому.
Для определения степени окисления атомов в химических соединениях следует руководствоваться следующими положениями:
а) атомы кислорода в соединениях проявляют степень окисления —2 (за исключением фторокислорода OF2 и пероксидов металлов Ме2О2, в которых степень окисления кислорода равна соответственно +2 и —1);
|
|
|
б) атом водорода в соединениях проявляет степень окисления +1
(за исключением гидридов металлов МеН, в которых степень окисления водорода равна —1);
в) степень окисления атомов в молекулах простых веществ равна 0, например:

г) молекула простого и сложного вещества электронейтральна, т.е. суммы положительных и отрицательных зарядов в ней равны;
д) степени окисления постоянны у щелочных металлов +1, у щелочноземельных +2;
е) степень окисления неизвестного атома вычисляется через известные степени окисления других атомов.
Пример
Определить степень окисления хрома в молекуле К2Cr2О7.
Решение
 .
.
Из условия электронейтральности молекулы составляем уравнение:
2×1+2×х — 2×7 = 0
2х = 14 — 2
2х = 12; х = 6.
Степень окисления хрома равна +6.
Пример
Определить степень окисления фосфора в молекуле Са3(РО4)2.
Решение
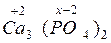
2×3+(х — 2×4)×2 = 0
2х = 10; х = 5.
Степень окисления фосфора равна +5.
Современная теория окислительно-восстановительных реакций основана на следующих положениях:
1) процесс окисления заключается в отдаче электронов окисляющимся веществом; степень окисления при этом повышается, например:
|
|
|
 .
.
Атомы или ионы, отдающие электроны, называются восстановителями.
Типичными восстановителями являются:
а) элементы IА и IIА групп;
б) простые и сложные анионы, в которых болееэлектро-отрицательный элемент не имеет предельной степени окисления:
 и т.д.;
и т.д.;
в) катионы с промежуточной степенью окисления, которая можетвозрастать:
 ;
;
г) некоторые вещества при высоких температурах: С, СО, Н2;
2) процесс восстановления заключается в присоединении электронов восстанавливающимся веществом, степень окисления при этом понижается, например: 
 .
.
Атомы или ионы, присоединяющие электроны, называются окислителями.
Типичными окислителями являются:
а) простые вещества, атомы которых обладают большой электроотрицательностью (элементы VIА, VIIА групп), например, фтор, кислород, хлор;
б) простые катионы с высокой степенью окисления, например,  и сложные анионы, в которых менее электроотрицательный элемент проявляет высшую степень окисления:
и сложные анионы, в которых менее электроотрицательный элемент проявляет высшую степень окисления:
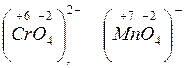 и т.д.;
и т.д.;
в) пероксиды металлов ВаО2, Nа2О2 и др.;
3) окисление невозможно без одновременно протекающего восстановления и наоборот.
Дата добавления: 2019-09-13; просмотров: 143; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
