ЦИКЛ КАРНО. ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
Преобразование тепла в механическую работу
В каждом тепловом двигателе тепло переходит в работу в результате расширения рабочего тела (газа или пара). Для продолжительной безостановочной работы двигателя необходимо постоянное повторение работы телом процесса расширения. Такое повторение осуществимо двумя способами.
1. Рабочее вещество, совершившее процесс расширения, удаляется из двигателя; затем в двигатель вводится новая порция рабочего вещества в том количестве и того же начального состояния, что и предыдущая, и процесс расширения повторяется. В принципе именно так работают двигатели внутреннего сгорания.
2. Рабочее тело, совершившее процесс расширения, возвращается путем сжатия в начальное состояние, после чего процесс повторяется. Этот способ представляет большой теоретический интерес. Рассмотрим его.

Рис. 7.1.1
Пусть рабочее тело, расширяясь, перейдет из состояния 1 в состояние 2, а затем снова сожмется, переходя в начальное состояние 1 (рис. 7.1.1, а).
Для того, чтобы работа, затраченная на сжатие, была меньше работы полученной в процессе расширения, кривая сжатия на диаграмме  должна лежать ниже кривой расширения, т.е. давление (а, следовательно, и температура) в процессе расширения должно быть больше, чем давление при сжатии. Для этого рабочему телу нужно в ходе расширения сообщить тепло, а в ходе сжатия отнимать от него тепло.
должна лежать ниже кривой расширения, т.е. давление (а, следовательно, и температура) в процессе расширения должно быть больше, чем давление при сжатии. Для этого рабочему телу нужно в ходе расширения сообщить тепло, а в ходе сжатия отнимать от него тепло.
|
|
|
При расширении рабочее тело (газ) совершает положительную работу А1; в процессе сжатия внешние силы совершают работу над газом или газ совершает отрицательную работу против внешних сил А2. Т.к.  , то в результате возвращения в начальное состояние рабочее тело совершает полезную работу:
, то в результате возвращения в начальное состояние рабочее тело совершает полезную работу:  , численно равную в данном масштабе заштрихованной площади цикла (рис. 7.1.1, а).
, численно равную в данном масштабе заштрихованной площади цикла (рис. 7.1.1, а).
Первое начало термодинамики для кругового процесса запишется следующим образом:
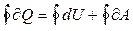 . (7.1.1)
. (7.1.1)
Изменение внутренней энергии за цикл  . Рабочее тело за цикл совершает работу А, т.е.
. Рабочее тело за цикл совершает работу А, т.е.  . Если Q1 – тепло, полученное рабочим телом при расширении, Q2 – тепло, отданное рабочим телом при сжатии, то количество тепла, сообщенное рабочему телу за цикл, равно
. Если Q1 – тепло, полученное рабочим телом при расширении, Q2 – тепло, отданное рабочим телом при сжатии, то количество тепла, сообщенное рабочему телу за цикл, равно
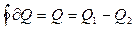 . (7.1.2)
. (7.1.2)
Таким образом, первое начало термодинамики для цикла имеет вид
 . (7.1.3)
. (7.1.3)
Т.к. в данном случае 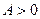 , то и
, то и  , т.е. рабочее тело совершает работу против внешних сил за счет тепла, сообщенного телу за цикл. Это и есть принцип действия тепловой машины. Указанный цикл, по которому работает тепловая машина, называется прямым. Направление процессов в прямом цикле совпадает с направлением движения часовой стрелки (кривая расширения проходит выше кривой сжатия).
, т.е. рабочее тело совершает работу против внешних сил за счет тепла, сообщенного телу за цикл. Это и есть принцип действия тепловой машины. Указанный цикл, по которому работает тепловая машина, называется прямым. Направление процессов в прямом цикле совпадает с направлением движения часовой стрелки (кривая расширения проходит выше кривой сжатия).
|
|
|
Как следует из соотношения (7.1.3) не все полученное тепло Q1 используется для получения полезной работы А1, часть тепла Q2 должна быть возвращена во внешнюю среду. Очевидно, что чем полнее превращает тепловая машина получаемое извне тепло Q1 в полезную работу А, тем эта машина выгоднее.
Отношение полезной работы цикла А к получаемому за цикл теплу Q1 называется термическим коэффициентом полезного действия h (КПД).
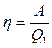 . (7.1.4)
. (7.1.4)
Приняв во внимание соотношение (7.1.3), выражения для КПД можно записать в виде
h  . (7.1.5)
. (7.1.5)
Очевидно, что КПД не может быть больше единицы.
Рассмотрим цикл, обратный по отношению к циклу, изображенному на рис. 7.1.1, а. При обратном цикле (рис. 7.1.1, б) кривая расширения проходит ниже кривой сжатия, т.е. цикл совершается против движения часовой стрелки.
Это цикл холодильных машин и тепловых насосов. Такая машина отбирает за цикл от тела с температурой Т2 количество тепла Q2 и отдает телу с более высокой температурой Т1 количество тепла Q1. За цикл совершается работа 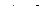 , это значит, что над машиной за цикл совершается работа
, это значит, что над машиной за цикл совершается работа  . Эффективность холодильной машины характеризует ее холодильным коэффициентом, который равен отношению отнятого от охлаждаемого тела тепла Q2 к работе
. Эффективность холодильной машины характеризует ее холодильным коэффициентом, который равен отношению отнятого от охлаждаемого тела тепла Q2 к работе  , которая затрачивается внешними силами на приведение машины в действие:
, которая затрачивается внешними силами на приведение машины в действие:
|
|
|
Холодильный коэффициент: 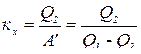 .
.
Вывод: по прямым циклам работают все тепловые машины, преобразующие теплоту в механическую работу. Обратные циклы характерны для холодильных установок.
Ц икл карно
Для работы теплового двигателя необходимо наличие двух тепловых резервуаров: нагревателя, высшего источника тепла, имеющего более высокую температуру Т1, от которого рабочее тело в процессе расширения получает количество тепла Q1, и холодильника, низшего источника тепла, имеющего более низкую температуру Т2, которому рабочее тело отдает тепло Q2 в процессе сжатия.
Рассмотрим прямой обратимый цикл идеального теплового двигателя, состоящего из двух изотерм и двух адиабат (рис. 7.2.1). Этот теоретический цикл был разработан французским инженером и физиком Сади Карно в 1824 г. и носит его имя.
 Цикл Карно интересен в двух аспектах. Во-первых, он является экономичным циклом и в связи с этим может служить эталоном совершенства реальных циклов. Во-вторых, анализ этого цикла позволяет установить весьма важные свойства тепла и условия превращения его в механическую работу.
Цикл Карно интересен в двух аспектах. Во-первых, он является экономичным циклом и в связи с этим может служить эталоном совершенства реальных циклов. Во-вторых, анализ этого цикла позволяет установить весьма важные свойства тепла и условия превращения его в механическую работу.
|
|
|
В цикле Карно рабочее тело (газ) расширяется сначала по изотермически 1 – 2, получая тепло Q1 от нагревателя с постоянной температурой Т1. В точке 2 подвод тепла к рабочему телу прекращается, но газ продолжает расширяться по адиабате 2 – 3, понижая температуру от Т1 до Т2. Из состояния 3 газ возвращается в начальное состояние также в два приема: сначала сжимается по изотерме 3 – 4, затем по адиабате 4 – 1. При изотермическом сжатии газ отдает тепло Q2 холодильнику с постоянной температурой Т2. Отвод тепла прекращается в точке 4, которая выбирается так, чтобы при последующем адиабатическом сжатии газ возвратился в исходное состояние 1.
Таким образом, рабочее тело, совершив цикл Карно, получает извне тепло Q1, часть тепла Q2 отдает холодильнику и производит положительную работу А, эквивалентную площади цикла на диаграмме (р – V) (рис. 7.2.1).
Поскольку формулы (7.1.4) и (7.1.5) термического КПД справедливы для любых циклов, то их можно применить и для цикла Карно, то есть:

 . (7.2.1)
. (7.2.1)
Выразим КПД цикла Карно через значения абсолютных температур нагревателя и холодильника (через Т1 и Т2). В цикле Карно тепло подводится и отводится в изотермических процессах. А для этих процессов работа расширения и сжатия совершается за счёт поступления и отвода тепла Q1 и Q2 (в изотермическом процессе изменение внутренней энергии dU = 0). Для изотерм согласно формуле  можно и записать
можно и записать
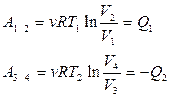 . (7.2.2)
. (7.2.2)
 , (7.2.3)
, (7.2.3)
где Q 1 – количество тепла, полученного от нагревателя; Q 2 – количество тепла, отданное холодильнику.
Запишем уравнение  для адиабат 2 – 3 и 4 – 1 через соответствующие параметры:
для адиабат 2 – 3 и 4 – 1 через соответствующие параметры:
 адиабата 2 – 3;
адиабата 2 – 3;
 адиабата 4 – 1.
адиабата 4 – 1.
Сравнение последних выражений дает
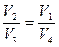 или
или  . (7.2.4)
. (7.2.4)
Подставляем выражение (7.2.4) в выражение (7.2.2) и (7.2.3) получим
 ; (7.2.5)
; (7.2.5)
 . (7.2.6)
. (7.2.6)
В этих формулах d есть отношение большего объема к меньшему в изотермических процессах расширения и сжатия соответственно. Подставим выражения (7.2.5) и (7.2.6) в выражение (7.2.1).
 .
.
Окончательно КПД цикла Карно:
 .
.
Эта формула справедлива только для цикла Карно. При её выводе не делалось никаких предположений о свойствах рабочего тела и устройстве тепловой машины. Отсюда следует утверждение, называемое теоремой Карно: коэффициент полезного действия тепловой машины, работающей по циклу Карно, зависит только от температур Т1 и Т2 нагревателя и холодильника и не зависит от устройства машины, а также от вида рабочего вещества.
Анализ последнего выражения позволяет сделать следующие важные выводы.
1. Термический КПД цикла Карно возрастает с увеличением температуры нагревателя Т1 и уменьшением температуры холодильника Т2. Иными словами, КПД возрастает с увеличением температурного перепада (Т1 – Т2).
2. Термический КПД даже самого совершенного цикла, каковым является цикл Карно, меньше единицы. Действительно h = 1 либо при Т2 = 0, либо при Т1 = ¥, что невозможно. Поскольку h < 1, то согласно формуле 
 A < Q1. А это значит, что нельзя все тепло, подведенное в цикле к рабочему телу, превратить в полезную работу! Всегда часть тепла отдается рабочим телом холодильнику.
A < Q1. А это значит, что нельзя все тепло, подведенное в цикле к рабочему телу, превратить в полезную работу! Всегда часть тепла отдается рабочим телом холодильнику.
3. При равенстве температур нагревателя и холодильника (Т1 = Т2) h = 0 и, следовательно, полезная работа А = 0, т.е. превращение тепла в работу невозможно без наличия температурного перепада. Это означает, что для трансформации тепла в работу необходимо кроме источника тепла (нагревателя) иметь еще и приемник тепла (холодильник).
В заданном интервале температур нагревателя и холодильника цикл Карно по сравнению с любыми другими реальными циклами имеет наивысшее значение термического КПД, т.е. цикл Карно наиболее экономичен в смысле преобразования тепла в работу.
В реальных случаях неизбежны потери тепла на нагревание частей машины, трение и другие необратимые процессы теплопроводности. Следовательно, реальные циклы необратимы, а их КПД меньше КПД идеального обратимого цикла Карно.
 .
.
Для любого цикла, в том числе и необратимого, согласно формуле (7.1.1) КПД равно
 ,
,
для идеального обратимого цикла КПД определяется формулой
 ,
,
то есть
 .
.
Здесь знак равенства реализуется для обратимого цикла, знак неравенства – для необратимого цикла.
В торое начало термодинамики
Первое начало термодинамики является выражением закона сохранения энергии для изолированной системы в наиболее общей формулировке. Если для системы возможны два состояния 1 и 2, то из первого начала термодинамики нельзя точно сказать, будет ли система переходить из состояния 1 в состояние 2 или из состояния 2 в состояние 1.
Вообще, на основании первого начала нельзя выяснить, будут ли в изолированной системе происходить какие-либо процессы и в каком направлении. Например, первому началу не противоречил бы процесс, в котором тепло самопроизвольно переходит от тела менее нагретого к телу более нагретому.
Второе начало термодинамики позволяет судить о направлении процессов, которые могут происходить в действительности. Кроме того, оно совместно с первым началом позволяет также установить точные количественные соотношения между различными макроскопическими параметрами тел в состоянии термодинамического равновесия.
Многочисленные опыты показали, что превращение любого вида энергии в тепло не связано с какими-либо ограничениями и затруднениями. Превращение же тепла в механическую энергию возможно лишь при определенных условиях, что объясняется особыми свойствами тепла.
Рассмотрим некоторые из этих свойств.
Свойства тепла
1. Тепло, сообщенное рабочему телу в прямом цикле, не может быть полностью превращено в работу. Часть тепла обязательно теряется, переходя с высшего температурного уровня на низший. Это свойство тепла было установлено при анализе формулы термического КПД цикла Карно.
2. Все естественные тепловые процессы в природе протекают односторонне, т.е. в этих процессах тепло от тел более нагретых переходит к телам менее нагретым. Перевод тепла с низшего температурного уровня на высший в естественных процессах невозможен. Чтобы перевести тепло от менее нагретого тела к более нагретому, необходимо затратить работу (холодильная машина).
3. По современным воззрениям тепло обусловлено хаотическим движением молекул. Хаотическое движение является наиболее вероятным. Действительно, либо упорядоченное движение молекул легко нарушается, т.е. переходит в беспорядочное. Переход от более вероятного состояния к менее вероятному возможен только при определенных условиях. Поэтому все естественные тепловые процессы являются переходом от менее вероятных состояний к состояниям более вероятным.
Отмеченные свойства тепла, а также условия преобразования тепла в механическую работу фиксируется вторым началом термодинамики. Оно было установлено на основе огромного экспериментального материала.
Сущность второго начала выражается несколькими формулировками, данными разными авторами.
1. Для перевода тепла в работу необходимо наличие, кроме источника тепла, иметь охладитель более низкой температуры (С. Карно (1796 - 1832) - французский физик, инженер).
2. Тепло само по себе не может перейти от более холодного тела к более теплому (Р. Клаузиус (1822 - 1888) - немецкий физик теоретик).
3. Физический смысл II начала: невозможен такой периодический процесс, единственным результатом которого было бы превращение тепла в работу (Планк).
Невозможен круговой процесс, единственным результатом которого была бы механическая работа, совершаемая за счет охлаждения тепла резервуара. (В. Томсон, получивший за научные заслуги титул лорда Кельвина (1824 - 1907) – английский физик).
Перпетуум мобиле второго рода невозможен. (В. Оствальд (1853 – 1932) – немецкий физик-химик).
Возможность создания перпетуум мобиле первого рода, т.е. вечного двигателя, производящего работу из ничего, отрицается законом сохранения энергии. Перпетуум мобиле второго рода представлял бы собой периодически действующую тепловую машину без холодильника, т.е. Q2 = 0 и, следовательно, согласно формуле  h = 1. Такая машина могла бы превратить в работу все тепло, полученное от одного теплового резервуара. Возможность ее построения не противоречит закону сохранения энергии, но противоречит постулатам второго начала термодинамики, которые покоятся на надежной экспериментальной основе. Если бы была возможность построения такого вечного двигателя, то с его помощью можно было бы производить работу за счет практически неисчерпаемых запасов внутренней энергии, содержащихся в воде океанов и море, воздушной атмосфере и недрах Земли.
h = 1. Такая машина могла бы превратить в работу все тепло, полученное от одного теплового резервуара. Возможность ее построения не противоречит закону сохранения энергии, но противоречит постулатам второго начала термодинамики, которые покоятся на надежной экспериментальной основе. Если бы была возможность построения такого вечного двигателя, то с его помощью можно было бы производить работу за счет практически неисчерпаемых запасов внутренней энергии, содержащихся в воде океанов и море, воздушной атмосфере и недрах Земли.
Все естественные тепловые процессы являются переходом от менее вероятных к более вероятным состояниям. (Л. Больцман (1844 - 1906) – австрийский физик-теоретик).
Лекция 8

ПОНЯТИЕ ЭНТРОПИИ
Приведенное количество тепла
Из рассмотрения цикла Карно было получено неравенство  , которое может быть записано следующим образом:
, которое может быть записано следующим образом:

или после преобразования получим
 .
.
Заменим количество тепла Q2, отданное холодильнику, теплом  , полученным от холодильника
, полученным от холодильника  , то получим неравенство
, то получим неравенство
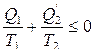 . (8.1.1)
. (8.1.1)
Это неравенство носит название неравенства Клаузиуса.
При передаче тепла важно учитывать не только количество переданного тепла, но и его качество. А это качество зависит от того, при какой температуре тепло от одного тела передается другому. Чем выше температура, при которой передается тепло, чем лучше качество этого тепла. Для учета качества полученного тепла вводят понятие приведенного тепла.
Отношение полученного тепла к той температуре (  ), при которой происходит теплопередача, называется приведенным количеством тепла, или более кратко приведенным теплом.
), при которой происходит теплопередача, называется приведенным количеством тепла, или более кратко приведенным теплом.
Неравенство (8.1.1) приведено для системы, состоящей из рабочего тела, нагревателя и холодильника. Если рабочее тело за цикл имеет контакт с n парами нагревателей и холодильников, то неравенство (8.1.1) примет вид
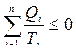 . (8.1.2)
. (8.1.2)
В неравенстве Клаузиуса имеется ввиду, что температура в процессе теплопередачи не изменяется. Однако если какое-либо тело отдает тепло, то его температура понижается, если же тело получает тепло, то его температура повышается. Поэтому, для того, чтобы считать температуру тела при передаче постоянной, нужно передавать тепло малыми порциями, т.е.,
 (8.1.3)
(8.1.3)
или
 - неравенство Клаузиуса (8.1.4)
- неравенство Клаузиуса (8.1.4)
Таким образом, можно сделать следующие выводы:
- сумма приведенных теплот в любом цикле не превышает нуля;
- для обратимого цикла сумма приведенных теплот равна нулю, т.е.  ;
;
- для необратимого цикла сумма приведенных теплот меньше нуля, т.е.  .
.
П онятие энтропии
Для обратимого цикла:
 , (8.2.1)
, (8.2.1)
то есть  является полным дифференциалом некоторой функции. Эта функция называется энтропией и обозначается буквой S.
является полным дифференциалом некоторой функции. Эта функция называется энтропией и обозначается буквой S.
Но изменение внутренней энергии за цикл 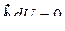 , а внутренняя энергия является функцией состояния, то есть:
, а внутренняя энергия является функцией состояния, то есть:
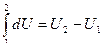 .
.
По аналогии  является полным дифференциалом некоторой функции:
является полным дифференциалом некоторой функции:
 и
и  ,
,
то есть энтропия за цикл не изменяется и также является функцией состояния.
Наша задача доказать это. Рассмотрим произвольный обратимый термодинамический процесс (рис. 8.2.1).
 Пусть система (тело) из состояния А переходит в состояние В по обратимому процессу, изображаемому кривой А1В, а затем возвращается в исходное состояние по другому обратимому пути В2А. Тогда суммарное приведенное тепло согласно формуле (8.2.1) определится
Пусть система (тело) из состояния А переходит в состояние В по обратимому процессу, изображаемому кривой А1В, а затем возвращается в исходное состояние по другому обратимому пути В2А. Тогда суммарное приведенное тепло согласно формуле (8.2.1) определится
 . (8.2.2)
. (8.2.2)
Рассмотрим другой обратимый цикл А3В2А (рис. 8.2.1). Для этого цикла можно также записать
 . (8.2.3)
. (8.2.3)
Вычитая из выражения (8.2.2) выражение (8.2.3) и приводя подобные слагаемые, получаем

или
 . (8.2.4)
. (8.2.4)
Таким образом, получили, что сумма приведенных теплот в обратимых процессах не зависит от пути следования процесса (характера процесса), а определяется исключительно начальным (А) и конечным (В) состоянием системы. Отсюда следует, что подынтегральное выражение в формуле (8.2.4)  - есть изменение функции состояния. Другими словами: энтропия S системы (тела) является функцией состояния системы (тела).
- есть изменение функции состояния. Другими словами: энтропия S системы (тела) является функцией состояния системы (тела).
Если система переходит обратимым процессом из состояния А в состояние В, то
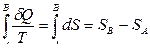 . (8.2.5)
. (8.2.5)
При совершении обратимого кругового процесса энтропия системы не изменяется.
 . (8.2.6)
. (8.2.6)
Следовательно, энтропия – важная характеристика. Для решения важных практических задач используется, как правило, диаграмма р – V, но иногда удобно использовать диаграмму T – S, применяемую часто в термодинамике.
 Из определения энтропии
Из определения энтропии

и определяется площадь заштрихованной на рис. 8.2.2 полоски.
Вся площадь под кривой – есть полное количество теплоты. Так как знаки dS и d Q совпадают, то по характеру изменения энтропии можно судить о направлении процесса. Если для данного тела dS > 0, то и d Q > 0, то есть тело нагревается, а это значит, что тело получает это количество тепла; если же dS < 0, то и d Q < 0 – тело охлаждается.
По энтропии можно судить о направлении процесса, т.е. какое состояние является начальным, а какое состояние является конечным.
Для адиабатического процесса (система теплоизолирована) данная система в целом не получает извне и не отдает внешним телам тепло, т.е. всегда d Q = 0. Тогда в соответствии с равенством (8.2.5):

или
 ,
,
то есть для изолированной системы энтропия S = const, и адиабатический процесс является изоэнтропийным процессом.
Отсюда следует важный вывод: энтропия изолированной системы в обратимом процессе не изменяется.

Графическое представление.
Рис. 8.2.3
Изотермический процесс
Прямая 1-1’, проходящая через точку 0 параллельно оси абсцисс (О – 1 – изотермическое расширение: теплота подводится; dS > 0; О – 1’ – изотермическое сжатие: теплота отбирается, dS < 0).
Дата добавления: 2019-09-13; просмотров: 723; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
