ЯВЛЕНИЯ МОЛЕКУЛЯРНОГО ПЕРЕНОСА
Общая характеристика явлений
Молекулярного переноса
До сих пор мы рассматривали газ, находящийся в равновесном состоянии. Такое состояние характеризуется одинаковыми значениями во всех точках объема газа таких величин, как температура, давление, концентрация молекул разного сорта и т.п. Теперь рассмотрим явления, возникающие при отклонении газа от равновесного состояния.
Раздел физики, изучающий процессы, возникающие при нарушениях равновесия, называется физической кинетикой.
Напомним, что статистическая физика имеет дело только с равновесными состояниями тел.
При нарушении равновесия система стремится вернуться в равновесное состояние. То есть, нарушение равновесия сопровождается переносом либо массы, либо тепла, либо импульса. В связи с этим соответствующие процессы носят название явлений переноса. Явления переноса представляют собой необратимые процессы.Явление переноса – это явление выравнивания неоднородностей в жидкости или газе.
Виды явлений переноса:
- теплопроводность (обусловлена переносом энергии);
- диффузия (обусловлена переносом массы);
- внутреннее трение или вязкость (обусловлено переносом импульса).
Беспорядочное, хаотическое движение молекул в газе ведет к их непрерывному перемешиванию. В результате происходит перенос либо массы вещества, либо теплоты, либо импульса (количества движения) в направлении, обратном их градиенту, то есть система приближается к состоянию термодинамического равновесия.
|
|
|
Вывод: все явления переноса обусловлены одним молекулярным механизмом – хаотическим движением и перемешиванием молекул.
Для количественного описания явлений переноса предварительно определим некоторые микровеличины, обусловленные хаотическим движением молекул.
С реднее число столкновений и средняя длина
Свободного пробега молекул
Молекулы, находясь в газе в состоянии непрерывного хаотического движения, сталкиваются друг с другом: между столкновениями они проходят свободно некоторый путь l. Длина этого пути между столкновениями различна, но, благодаря большому числу столкновений и беспорядочности их движения, можно говорить о средней длине свободного пробега <l>.
Средняя длина свободного пробега (<l>) – это среднее расстояние, которое пролетает молекула между двумя столкновениями.
Для вычисления <l> будем пользоваться моделью твердых шаров, то есть представим молекулу в виде шарика диаметром d. Для упрощения расчетов предположим, что движется только одна молекула со средней скоростью < 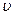 >, а все остальные молекулы неподвижны. После каждого столкновения молекула меняет направление скорости <
>, а все остальные молекулы неподвижны. После каждого столкновения молекула меняет направление скорости < 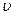 >, а между столкновениями она движется прямолинейно. Соударение произойдет в том случае, если центр неподвижной молекулы окажется от прямой, вдоль которой летит молекула, на расстоянии, не большем диаметра молекулы d, то есть встречная молекула должна находиться в пределах цилиндра радиуса d (рис. 4.2.1).
>, а между столкновениями она движется прямолинейно. Соударение произойдет в том случае, если центр неподвижной молекулы окажется от прямой, вдоль которой летит молекула, на расстоянии, не большем диаметра молекулы d, то есть встречная молекула должна находиться в пределах цилиндра радиуса d (рис. 4.2.1).
|
|
|
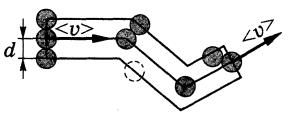
|
За секунду молекула проходит путь, равный < 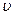 >.1 с. Тогда среднее число столкновений <Z> движущейся молекулы с остальными молекулами в единицу времени равно среднему числу молекул < Z > = N в объеме коленчатого цилиндра длины <
>.1 с. Тогда среднее число столкновений <Z> движущейся молекулы с остальными молекулами в единицу времени равно среднему числу молекул < Z > = N в объеме коленчатого цилиндра длины < 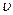 >.1 с и радиуса d.
>.1 с и радиуса d.
Поскольку средняя длина свободного пробега <l> много больше, чем диаметр молекулы d, то можно пренебречь теми частями объема, которые приходятся на изломы цилиндра, то есть объем цилиндра можно считать равным V = 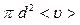 . Среднее число столкновений за секунду движущейся молекулы с неподвижными молекулами
. Среднее число столкновений за секунду движущейся молекулы с неподвижными молекулами
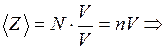 ;
; 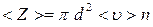 .
.
В действительности все молекулы движутся, следовательно, число соударений определяется средней скоростью движения молекул друг относительно друга, которая в 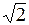 раз больше средней скорость, тогда число соударений будет определяться
раз больше средней скорость, тогда число соударений будет определяться
|
|
|
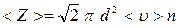 (4.2.1)
(4.2.1)
Так как за секунду молекула проходит в среднем путь, равный < 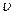 >1 с, и претерпевает в среднем <Z> столкновений, то средняя длина свободного пробега равна
>1 с, и претерпевает в среднем <Z> столкновений, то средняя длина свободного пробега равна
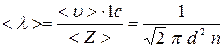 . (4.2.2)
. (4.2.2)
 Средняя длина свободного пробега зависит от диаметра молекулы. Следует иметь ввиду, что диаметр молекулы, вычисленный в предположении, что молекулы являются твердыми шарами, дает лишь некоторое приближенное представление о их размерах. Под диаметром молекул d следует понимать эффективный диаметр молекул – это наименьшие расстояние, на которое могут приблизиться центры молекул друг к другу при данной температуре. Он зависит от скорости сталкивающихся молекул, то есть от температуры. Процесс столкновения сводится к тому, что на малых расстояниях молекулы отталкиваются друг от друга, причем силы отталкивания возрастают по мере уменьшения расстояния между ними.
Средняя длина свободного пробега зависит от диаметра молекулы. Следует иметь ввиду, что диаметр молекулы, вычисленный в предположении, что молекулы являются твердыми шарами, дает лишь некоторое приближенное представление о их размерах. Под диаметром молекул d следует понимать эффективный диаметр молекул – это наименьшие расстояние, на которое могут приблизиться центры молекул друг к другу при данной температуре. Он зависит от скорости сталкивающихся молекул, то есть от температуры. Процесс столкновения сводится к тому, что на малых расстояниях молекулы отталкиваются друг от друга, причем силы отталкивания возрастают по мере уменьшения расстояния между ними.
Из формулы (4.2.2) видно, что <l> обратнопропорциональна концентрации молекул п. С повышением температуры увеличиваются скорости движения молекул и, следовательно, молекулы могут ближе подойти друг к другу за счет запаса своей кинетической энергии. Таким образом, с повышением температуры, уменьшается эффективный диаметр молекулы d, а следовательно, увеличивается средняя длина свободного пробега <l>.
|
|
|
Концентрация молекул газа связана с давлением газа формулой 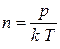 . Подставляя это выражение в формулу (4.2.2), получим
. Подставляя это выражение в формулу (4.2.2), получим
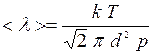 .
.
При постоянной температуре средняя длина свободного пробега обратно пропорциональна давлению.
Д иффузия в газах
Диффузией называется явление проникновения молекул одного вещества в межмолекулярные промежутки другого. В результате диффузии вещества перемешиваются, становятся однородными, то есть тепловое движение молекул приводит к выравниванию концентраций (плотностей) в смеси нескольких различных веществ.
Этот процесс наблюдается в твердых, жидких и газообразных средах.
Мы ограничимся рассмотрением только газообразных сред.
Пусть в газе присутствует посторонняя примесь (пары эфира) с концентрацией п, которая в данный момент времени имеет различное значение в разных точках объема и зависит некоторым образом от пространственной координаты x, как показано на графике n = f (x) (рис. 4.3.1).

|
Рис. 4.3.1
Если в точке с координатой x концентрация имеет величину п, то в соседней точке с координатой x + dx значение концентрации равно п + d п. Изменение концентрации dn может быть как положительным, так и отрицательным.
Отношение 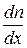 называется градиентом концентрации. Численное значение
называется градиентом концентрации. Численное значение 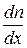 показывает изменение концентрации dn в пространстве при перемещении на единицу длины (при dx = 1).
показывает изменение концентрации dn в пространстве при перемещении на единицу длины (при dx = 1).
Наблюдения показывают, что при диффузии через перпендикулярную к оси x площадку dS переносится тем больше число молекул dN примесного газа, чем больше размеры площадки dS, промежуток времени dt, за который наблюдается диффузия, и градиент концентрации 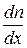 .
.
dN~ dS; dN~ dt;
dN~ 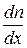 ;
;
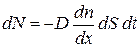 , (4.3.1)
, (4.3.1)
где D – коэффициент пропорциональности, называемый коэффициентом диффузии.
Умножив обе части равенства (4.3.1) на массу т0 молекулы диффундирующего газа, получим
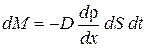 , (4.3.2)
, (4.3.2)
где r = т0 п; dM = m 0 d N – масса перенесенного вещества.
Знак «-» показывает, что масса переносится в сторону убывания плотности. Поэтому знаки dM и 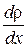 - противоположны по знаку.
- противоположны по знаку.
Уравнение (4.3.2) можно переписать в виде
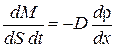 . (4.3.3)
. (4.3.3)
Полученное выражение представляет собой эмпирическое уравнение диффузии. Его называют уравнение Фика.
Величина 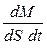 называется плотностью потока диффузии. Плотность потока диффузии показывает, какая масса вещества dM переносится в единицу времени через единичную площадку перпендикулярно этой площадке. Из уравнения (4.3.3)
называется плотностью потока диффузии. Плотность потока диффузии показывает, какая масса вещества dM переносится в единицу времени через единичную площадку перпендикулярно этой площадке. Из уравнения (4.3.3)
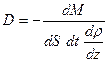 .
.
Коэффициент диффузии показывает, какая масса вещества переносится через единицу площади в единицу времени при градиенте плотности, равном единице.
Единица измерения коэффициента диффузии
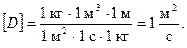
Формула (4.3.3) характеризует явление диффузии с макроскопической точки зрения. Рассмотрим теперь явление диффузии с точки зрения молекулярно-кинетической теории газов.
Пусть градиент концентрации молекул примесного газа поддерживается постоянным вдоль какого-либо направления, например, вдоль оси x, то есть 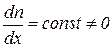 . Хаотическое движение будет стремиться выровнять концентрации, и возникнет поток молекул примеси dN, направленный в сторону убывания концентрации.
. Хаотическое движение будет стремиться выровнять концентрации, и возникнет поток молекул примеси dN, направленный в сторону убывания концентрации.
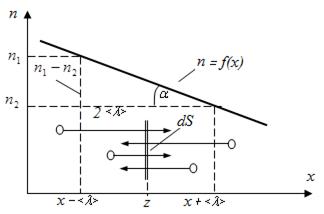
Рис. 4.3.2
Вычислим этот поток. Расположим в плоскости x = const контрольную площадку dS перпендикулярно к оси x. Пусть концентрация 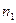 слева от площадки больше концентрации
слева от площадки больше концентрации 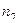 справа (n1>n2).
справа (n1>n2).
Вследствие теплового движения молекулы будут переходить через площадку dS как справа налево, так и слева направо.
Ввиду полной беспорядочности движения молекул считаем, что вдоль оси x движется 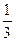 часть всех молекул, из них половина – в направлении положительной оси x и половина – в направлении отрицательной оси x.
часть всех молекул, из них половина – в направлении положительной оси x и половина – в направлении отрицательной оси x.
Таким образом, в данном направлении к площадке dS летит 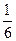 часть всех молекул.
часть всех молекул.
Обозначим через 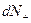 число молекул, пролетающих за время dt через площадку dS в положительном направлении оси x; через
число молекул, пролетающих за время dt через площадку dS в положительном направлении оси x; через 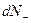 - то же число молекул для отрицательного направления оси x.
- то же число молекул для отрицательного направления оси x.
Тогда
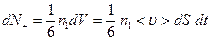 ;
;
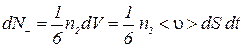 ,
,
где 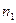 и
и 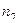 - концентрации молекул слева и справа от площадки соответственно; <
- концентрации молекул слева и справа от площадки соответственно; < 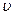 > - средняя скорость теплового движения молекул, одинаковая для всех молекул примесного газа.
> - средняя скорость теплового движения молекул, одинаковая для всех молекул примесного газа.
Разность dN = dN + - dN - - дает поток молекул за время dt через площадку dS
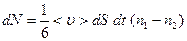 . (4.3.4)
. (4.3.4)
Так как концентрация п меняется от точки к точке непрерывно, то следует определить, каким значениям координат соответствуют величины 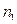 и
и 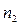 . Через площадку dS будут пролетать молекулы, претерпевшие последнее соударение на различных расстояниях от плоскости x = const, в которой расположена площадка dS. Однако в среднем последнее соударение происходит на расстоянии от площадки, равном средней длине свободного пробега <l>. Так как выравнивание концентраций происходит лишь в результате взаимных столкновений, на расстоянии <l> концентрация молекул не меняется.
. Через площадку dS будут пролетать молекулы, претерпевшие последнее соударение на различных расстояниях от плоскости x = const, в которой расположена площадка dS. Однако в среднем последнее соударение происходит на расстоянии от площадки, равном средней длине свободного пробега <l>. Так как выравнивание концентраций происходит лишь в результате взаимных столкновений, на расстоянии <l> концентрация молекул не меняется.
Таким образом, в плоскости x -<l> = const концентрация молекул равна 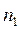 , а в плоскости x +<l> = const концентрация молекул равна
, а в плоскости x +<l> = const концентрация молекул равна 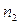 . Из графика зависимости п = f(x) видно, что
. Из графика зависимости п = f(x) видно, что 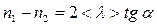 , но
, но 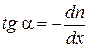 , тогда
, тогда 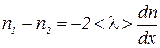 .
.
Подставляя это выражение в уравнение (4.3.4), получим
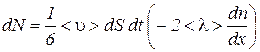
или
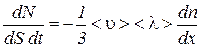 .
.
Умножим обе части этого выражения на массу т0 одной молекулы (т0 = const)
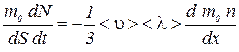
или
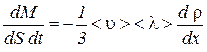 .
.
Сравнивая это выражение с уравнением диффузии (4.3.3), получим коэффициент диффузии
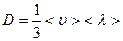 . (4.3.5)
. (4.3.5)
Получили связь коэффициента диффузии с микроскопическими характеристиками < 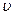 > и <l>.
> и <l>.
Так как и средняя скорость < 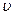 > и средняя длина свободного пробега <l> увеличиваются с повышением температуры, то и коэффициент диффузии D растет с температурой.
> и средняя длина свободного пробега <l> увеличиваются с повышением температуры, то и коэффициент диффузии D растет с температурой.
Подставив в (4.3.5) равенство (4.2.2) получим
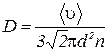 .
.
Следовательно, коэффициент диффузии зависит от эффективного диаметра молекул. В случае взаимной диффузии двух газов, молекулы которых различаются размерами, под эффективным диаметром (d) нужно подразумевать средний диаметр обоих газов
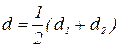 .
.
Дата добавления: 2019-09-13; просмотров: 948; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
