Р абота при изменении объема газа
Рассмотрим газ в цилиндре под поршнем (рис. 5.2.1).  Вычислим бесконечно малую (элементарную) работу d А, совершаемую газом при бесконечно малом расширении, в котором его объем увеличивается на dV. Считаем, что расширение газа происходит настолько медленно, что процесс является равновесным.
Вычислим бесконечно малую (элементарную) работу d А, совершаемую газом при бесконечно малом расширении, в котором его объем увеличивается на dV. Считаем, что расширение газа происходит настолько медленно, что процесс является равновесным.
Сила давления газа на поршень равна 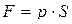 , где S – площадь поршня. Если поршень переместится на расстояние dx, то газ совершит работу:
, где S – площадь поршня. Если поршень переместится на расстояние dx, то газ совершит работу:
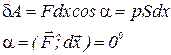 .
.
Так как изменение объема 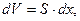 то
то
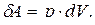 (5.2.1)
(5.2.1)
Если газ расширяется, то изменение объема газа 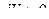 и, следовательно, работа расширения газа
и, следовательно, работа расширения газа 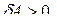 При расширении газ совершает положительную работу против внешних сил. Если же внешние силы сжимают газ, то изменение объема
При расширении газ совершает положительную работу против внешних сил. Если же внешние силы сжимают газ, то изменение объема 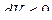 и работа сжатия газа
и работа сжатия газа 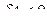 , т.е. при сжатии газ совершает отрицательную работу.
, т.е. при сжатии газ совершает отрицательную работу.
Т.о. формула (5.2.1) определяет выражение работы при любых бесконечно малых изменениях объема газа. Работа, совершаемая при конечных изменениях объема, должна вычисляться как сумма элементарных работ вида (5.2.1), то есть путем интегрирования:
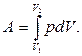 (5.2.2)
(5.2.2)
Найденные выражения для работы (5.2.1) и (5.2.2) справедливы при любых изменениях объема твердых, жидких и газообразных тел.
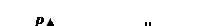 Изобразим процесс изменения объема газа на диаграмме (p – V) кривой I (рис. 5.2.2).
Изобразим процесс изменения объема газа на диаграмме (p – V) кривой I (рис. 5.2.2).
Элементарной работе 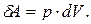 соответствует площадь узкой заштрихованной полоски на графике
соответствует площадь узкой заштрихованной полоски на графике 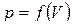 . Очевидно, что полная работа
. Очевидно, что полная работа 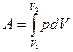 численно равна в данном масштабе площади фигуры, ограниченной осью V, кривой
численно равна в данном масштабе площади фигуры, ограниченной осью V, кривой 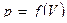 и прямыми V1 и V2. Если переход из состояния 1 в состояние 2 происходит так, что изменение давления с объемом представлено кривой II, то очевидно, что связанная с этим переходом работа будет другой: площади под кривыми процессов I и II различны.
и прямыми V1 и V2. Если переход из состояния 1 в состояние 2 происходит так, что изменение давления с объемом представлено кривой II, то очевидно, что связанная с этим переходом работа будет другой: площади под кривыми процессов I и II различны.
|
|
|
Таким образом, работа не определяется заданием начального и конечного состояния системы. Величина работы зависит от способа или «пути» перехода системы из начального состояния в конечное.
Вывод: в отличие от внутренней энергии работа А не является функцией состояния.
К оличество теплоты
Если привести в контакт горячее и холодное тело, то хаотически движущиеся молекулы горячего газа будут отдавать энергию молекулам холодного тела. Передача энергии может происходить также через излучение. Внутренняя энергия горячего тела переходит во внутреннюю энергию холодного тела, при этом макроскопическая работа не совершается, т.е. нет перемещения тела как целого.
Процесс обмена внутренними энергиями, не сопровождающийся производством макроскопической работы, называется теплообменом.
Энергия, переданная телу или полученная телом в результате теплообмена, называется количеством тепла или просто теплом.
|
|
|
Так как количество тепла Q является энергетической характеристикой, то Q нужно измерять в тех же единицах, что и энергию или работу.
В СИ единицей количества теплоты служит джоуль.
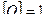 Дж.
Дж.
Количество теплоты, необходимое для нагревания газа, зависит от рода газа, его массы и от того на сколько должна быть изменена его температура. Чем больше то или другое, тем больше количество теплоты. Следовательно,
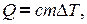
где 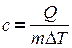 - удельная теплоемкость вещества – это физическая величина, численно равная количеству тепла, необходимого для нагревания 1 кг вещества на градус.
- удельная теплоемкость вещества – это физическая величина, численно равная количеству тепла, необходимого для нагревания 1 кг вещества на градус.
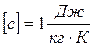 .
.
Обозначим 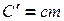 , тогда
, тогда 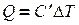 , где
, где 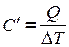 - теплоемкость вещества - это физическая величина, численно равная количеству тепла, необходимого для нагревания вещества на градус.
- теплоемкость вещества - это физическая величина, численно равная количеству тепла, необходимого для нагревания вещества на градус.
Впервые теплоемкость была введена в 1757 г. шотландским физиком и химиком Джозефом Блэком. Открытия Блэка взбудоражили научную Европу, и на авансцену выступила материальная природа теплоты.
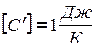 .
.
Умножим и разделим правую часть равенства 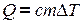 на молярную массу вещества.
на молярную массу вещества.
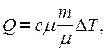
Обозначим 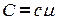 . Окончательно получим:
. Окончательно получим: 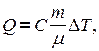
где 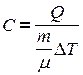 - молярная теплоемкость вещества – это физическая величина, численно равная количеству тепла, необходимого для нагревания 1 моля вещества на градус.
- молярная теплоемкость вещества – это физическая величина, численно равная количеству тепла, необходимого для нагревания 1 моля вещества на градус.
|
|
|
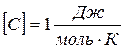 .
.
П ервое начало термодинамики
В любом состоянии тело обладает в общем случае механической и внутренней энергиями. При взаимодействии тела могут обмениваться энергией в той или иной форме энергия механического движения может превращаться в энергию теплового движения, то есть во внутреннюю энергию, и обратно. Опыт показывает, эти взаимные превращения одной формы в другую совершаются в строго эквивалентных количествах. Следовательно, во всех этих превращениях должен выполняться закон сохранения механической и тепловой энергий. Такая формулировка закона сохранения энергии получила название первого закона термодинамики (первого начала термодинамики).
Таким образом, первое начало термодинамики есть применение к тепловым явлениям закона сохранения и превращения энергии.
Внутренняя энергия термодинамической системы может изменяться за счет двух процессов: совершения над телом работы 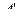 и сообщения ему количества тепла Q.
и сообщения ему количества тепла Q.
Пусть некоторая система переходит из состояния 1 в состояние 2. Например, определенное количество газа в цилиндре под поршнем сжимается внешними силами и одновременно нагревается в результате передачи некоторого количества тепла.
|
|
|
Приращение внутренней энергии системы должно быть равно сумме совершенной над системой работы 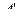 и количества сообщенного системе тепла Q.
и количества сообщенного системе тепла Q.
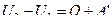 , (5.4.1)
, (5.4.1)
где U1 и U2 – начальное и конечное значение внутренней энергии системы.
Обычно вместо работы 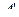 , совершаемой внешними телами над системой, рассматривают работу (А) совершаемую системой над внешними телами. По третьему закону Ньютона
, совершаемой внешними телами над системой, рассматривают работу (А) совершаемую системой над внешними телами. По третьему закону Ньютона 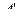 = -А. Тогда равенство (5.4.1) может быть записано
= -А. Тогда равенство (5.4.1) может быть записано
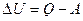
или
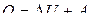 . (5.4.2)
. (5.4.2)
Уравнение (5.4.2) – закон сохранения энергии, представляет собой содержание первого закона (начала) термодинамики (в интегральной форме): количество тепла, сообщенное системе, идет на изменение внутренней энергии системы и на совершение системой работы над внешними телами.
Необходимо иметь ввиду, что величины Q и А являются алгебраическими: 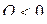 означает, что система не получает, а отдает тепло. Если
означает, что система не получает, а отдает тепло. Если 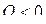
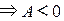 .
.
При вычислении совершенной системой работы или полученного системой тепла обычно приходится разбивать рассматриваемый процесс на ряд элементарных процессов, каждый из которых соответствует весьма малому (в пределе бесконечно малому) изменению параметров системы. Уравнение (5.4.2) для элементарного процесса в пределе имеет вид (первый закон термодинамики в дифференциальной форме)
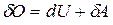 . (5.4.3)
. (5.4.3)
Почему же записываются обозначения бесконечно малых величин (d и d)? Так как внутренняя энергия U является функцией состояния тела, то изменение внутренней энергии не зависит от того, каким образом тело переходит из одного состояния в другое, а зависит лишь от свойств начального и конечного состояний. Поэтому, если после ряда изменений тело возвратилось в исходное состояние (совершился круговой процесс), то полное изменение внутренней энергии равно нулю. Математически это запишется
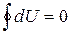 .
.
Следовательно, dU является полным дифференциалом (является функцией состояния). И тогда
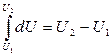
независимо от процесса перехода системы из состояния 1 в состояние 2.
Работа d А, совершаемая телом при переходе из состояния 1 в состояние 2 не является функцией состояния и зависит от процесса. Поэтому за цикл полная работа будет отлична от нуля, т.е.
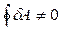 и
и 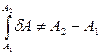 .
.
Отсюда следует, что d А не представляет собой полного дифференциала.
Так как 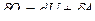 , то и количество тепла d Q не есть полный дифференциал, поскольку одно из слагаемых не является полным дифференциалом.
, то и количество тепла d Q не есть полный дифференциал, поскольку одно из слагаемых не является полным дифференциалом.
Это означает, что количество тепла будет разным в разных процессах перевода системы из состояния 1 в состояние 2, то есть d Q также не является функцией состояния и зависит от процесса. Для этой величины
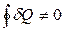 и
и 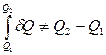 .
.
Такие обозначения подчеркивают, что количества d Q и d А являются какими-то бесконечно малыми величинами, но не приращениями определенных функций Q и А. Напротив, бесконечно малые изменения внутренней энергии мы обозначаем символом dU, тем самым указывая на то, что во всех без исключения случаях dU можно рассматривать как бесконечно малые приращения функции состояния U.
При переходе системы из состояния 1 в состояние 2 первое начало термодинамики может быть записано следующим образом.
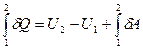 или
или 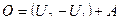 .
.
Это выражение тождественно уравнению (5.4.2). Пусть имеется периодически действующая машина, в которой газ (рабочее тело) в результате ряда процессов возвращается в исходное состояние, происходит замкнутый процесс или цикл. Тогда изменение внутренней энергии 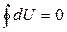 и из последнего выражения получаем
и из последнего выражения получаем
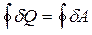 ,
,
то есть работа, совершаемая телом за цикл, равна подведенному количеству тепла.
Вывод: нельзя построить периодически действующий двигатель, который совершил бы работу без подвода энергии извне или совершил бы работу, большую, чем количество сообщенной ему извне энергии. Механизм, в котором мог бы осуществляться такой процесс, называется перпетуум мобиле (вечный двигатель) первого рода.
Следовательно, из первого начала термодинамики следует, что вечный двигатель первого рода невозможен.
Дата добавления: 2019-09-13; просмотров: 162; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
