Применение первого начала термодинамики
К изопроцессам
Среди равновесных процессов, происходящих с термодинамическими системами, выделяются изопроцессы, при которых один из основных параметров состояния (р, V или T) не изменяется, а так же масса и молярная масса газа остаются неизменными.
На основании соотношений 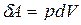 ,
, 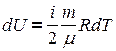 ,
, 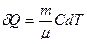 и
и 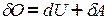 найдем выражение для первого закона термодинамики для всех изопроцессов.
найдем выражение для первого закона термодинамики для всех изопроцессов.
Изохорный процесс
 Начнем с рассмотрения процесса, протекающего при неизменном объеме газа (V = const) и называемого изохорическим (изохорным) процессом.
Начнем с рассмотрения процесса, протекающего при неизменном объеме газа (V = const) и называемого изохорическим (изохорным) процессом.
Диаграмма этого процесса (изохора)в координатах р- V изображается прямой, параллельной оси ординат (рис. 5.5.1), где процесс 1-2 есть изохорное нагревание, а 1-3 – изохорное охлаждение. При изохорном процессе газ работы не совершает над внешними телами, то есть 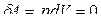 (dV = 0).
(dV = 0).
Из первого начала термодинамики:
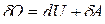 .
.
для изохорного процесса следует, что вся теплота, сообщаемая газу, идет на увеличение его внутренней энергии (первый закон термодинамики для изохорного процесса):
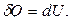
следовательно,
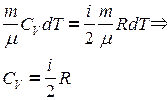 ,
,
где 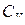 - изохорная молярная теплоемкость - это физическая величина, численно равная количеству тепла, необходимого для нагревания 1 моля вещества на градус при изохорном процессе.
- изохорная молярная теплоемкость - это физическая величина, численно равная количеству тепла, необходимого для нагревания 1 моля вещества на градус при изохорном процессе.
5.5.2. Изобарный процесс ( p = const )
Изобарным процессом называется термодинамический процесс, протекающий при постоянном давлении, массе и молярной массе в системе (p = const).
|
|
|
Такой процесс осуществляется, например, при нагревании или охлаждении газа, находящегося в цилиндре с подвижным, легким поршнем, на который действует постоянное внешнее давление.
 Диаграмма этого процесса (изобара) в координатах р, V изображается прямой 1-2, параллельной оси V.
Диаграмма этого процесса (изобара) в координатах р, V изображается прямой 1-2, параллельной оси V.
При изобарном процессе работа газа при расширении объема от V1 до V2 равна
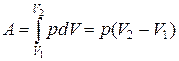
и определяется площадью заштрихованного прямоугольника. Если использовать уравнение Менделеева-Клапейрона для выбранных состояний, то
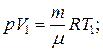
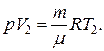
Откуда 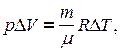 тогда выражение для работы изобарного расширения примет вид
тогда выражение для работы изобарного расширения примет вид
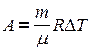
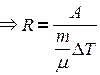 .
.
Из этого выражения вытекает физический смысл универсальной газовой постоянной R: универсальная газовая постоянная численно равна работе расширения одного моля идеального газа при нагревании его на 1 градус при изобарном процессе.
Первый закон термодинамики для изобарного процесса: 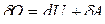
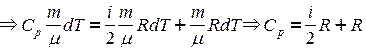 ;
;
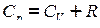 - уравнение Майера,
- уравнение Майера,
где 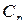 - изобарная молярная теплоемкость - это физическая величина, численно равная количеству тепла, необходимого для нагревания 1 моля вещества на градус при изобарном процессе.
- изобарная молярная теплоемкость - это физическая величина, численно равная количеству тепла, необходимого для нагревания 1 моля вещества на градус при изобарном процессе.
Из уравнения Майера видно, что 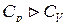 на величину универсальной газовой постоянной. Это объясняется тем, что при нагревании газа при постоянном давлении требуется еще дополнительное количество теплоты на совершение работы расширения газа, так как постоянство давления обеспечивается увеличением объема.
на величину универсальной газовой постоянной. Это объясняется тем, что при нагревании газа при постоянном давлении требуется еще дополнительное количество теплоты на совершение работы расширения газа, так как постоянство давления обеспечивается увеличением объема.
|
|
|
Воспользовавшись уравнением Майера можно показать, что
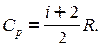
Отношение теплоемкости при постоянном давлении к теплоемкости при постоянном объеме называется коэффициентом Пуассона, или коэффициентом адиабаты.
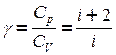 .
.
Коэффициент Пуассона зависит от числа степеней свободы и, следовательно, представляет собой характерную для каждого газа величину.
Значения i , CV , Cp , и 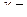 Cp / CV при комнатной температуре
Cp / CV при комнатной температуре
| Газ | i | CV | Cp | 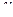
|
| Одноатомный | 3 | 3/2R | 5/2R | 1,67 |
| Двухатомный | 5 | 5/2R | 7/2R | 1,4 |
| Трёх- и более атомный | 6 | 3R | 4R | 1,33 |
5.5.3. Изотермический процесс ( T = const )
Найдем работу газа в изотермическом процессе:
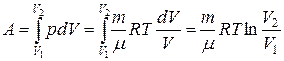
или
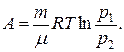
Из первого начала термодинамики:
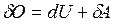
следует, что для изотермического процесса: 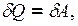 т.к. при T = const в идеальном газе его внутренняя энергия не изменяется:
т.к. при T = const в идеальном газе его внутренняя энергия не изменяется:
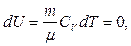
а все количество теплоты, сообщаемое газу, расходуется на совершение им работы против внешних сил (первый закон термодинамики для изотермического процесса).

Вывод: для того, чтобы при работе расширения температура не падала, к газу в течение изотермического процесса необходимо подводить количество теплоты, эквивалентное работе расширения.
|
|
|
Лекция 6

АДИАБАТИЧЕСКИЙ ПРОЦЕСС
Адиабатический процесс
Адиабатным (от греч. «адиабатос» - «непереходимый») называется процесс, при котором отсутствует теплообмен ( 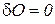 ) между термодинамической системой и окружающей средой. В этом процессе изменяются все три параметра р, V, T.
) между термодинамической системой и окружающей средой. В этом процессе изменяются все три параметра р, V, T.
При адиабатическом процессе газ не получает извне тепла и не отдает тепло окружающим телам. Для этого необходима идеальная тепловая изоляция газа от окружающей среды. Практически такой процесс осуществляется при достаточно быстром расширении и сжатии газа, когда теплообмен между газом и окружающей средой не успевает произойти.
Адиабатический процесс представляет собой большой практический интерес: он широко применяется в тепловых машинах и холодильных установках, в реактивных двигателях внутреннего сгорания, где воспламенение горячей смеси осуществляется путем адиабатического сжатия (явление пневматического огнива).
Из первого начала термодинамики ( 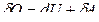 ) для адиабатного процесса следует
) для адиабатного процесса следует
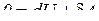 ;
;
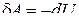 . (6.1.1)
. (6.1.1)
|
|
|
Первый закон термодинамики при адиабатическом процессе: работа производиться за счет убыли внутренней энергии системы. Если газ совершает положительную работу (расширение), его внутренняя энергия уменьшается, и температура газа понижается. Если под действием внешних сил газ сжимается, т.е. газ совершает отрицательную работу, то его внутренняя энергия увеличивается, и температура газа повышается.
Из определения молярной теплоемкости 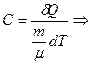 , что при адиабатном процесс
, что при адиабатном процесс 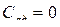 , так как
, так как 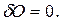
У равнения адиабаты
Рассмотрим как связаны между собой параметры p, V и Т, определяющие состояние идеального газа, когда он совершает адиабатный процесс.
Используя выражение: 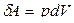 и
и 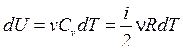 , для произвольной массы газа уравнение (6.1.1) можно записать в виде
, для произвольной массы газа уравнение (6.1.1) можно записать в виде
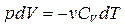 ;
;
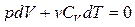 . (6.2.1)
. (6.2.1)
Чтобы найти соотношение между p и V, исключим из последнего равенства d Т.
Из уравнения Менделеева–Клапейрона 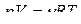 продифференцируя получим
продифференцируя получим
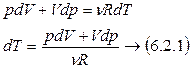 ;
;
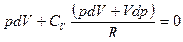 .
.
С учетом уравнения Р. Майера 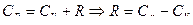 можно записать
можно записать
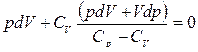 , приведем к общему знаменателю
, приведем к общему знаменателю
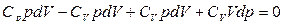 ;
;
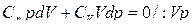 ;
; 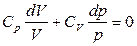 ;
;
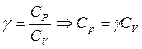 ;
; 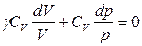 ;
;
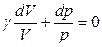 ,
,
так как для данного газа 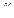 - постоянная величина, то можно написать
- постоянная величина, то можно написать
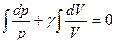 .
.
Интегрируя, получим
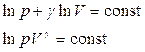 .
.
Потенцируя, получим:
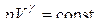 ; (6.2.2)
; (6.2.2)
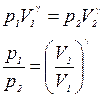 .
.
Уравнение (6.2.2) – уравнение адиабаты идеального газа в переменных p и V. Его называют также уравнением Пуассона (Пуассон вывел его теоретически в 1823 году), а 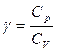 - показателем адиабаты, так как
- показателем адиабаты, так как 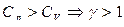 .
.
 Сопоставляя (6.2.2) с уравнением изотермы
Сопоставляя (6.2.2) с уравнением изотермы 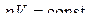 в p-V координатах адиабата идет круче изотермы. Диаграмма адиабатного процесса (адиабата) в переменных р- V изображается гиперболой (рис. 6.2.1).
в p-V координатах адиабата идет круче изотермы. Диаграмма адиабатного процесса (адиабата) в переменных р- V изображается гиперболой (рис. 6.2.1).
Адиабата 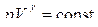 более круче, чем изотерма р V = const. Это объясняется тем, что при адиабатном сжатии увеличение давления газа обусловлено не только уменьшением его объема как при изотермическом сжатии, но и повышением температуры.
более круче, чем изотерма р V = const. Это объясняется тем, что при адиабатном сжатии увеличение давления газа обусловлено не только уменьшением его объема как при изотермическом сжатии, но и повышением температуры.
Это объясняется тем, что при адиабатном расширении происходит охлаждение газа, тогда как при изотермическом – температура поддерживается постоянной за счет притока эквивалентного количества теплоты.
Из уравнения Пуассона можно перейти к уравнениям адиабаты идеального газа в переменных T и V, p и T.
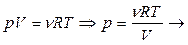 ; (6.2.2)
; (6.2.2)
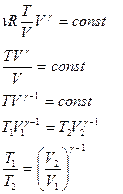 (6.2.3)
(6.2.3)
Из уравнения Менделеева – Клапейрона:
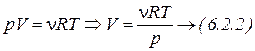 ;
;
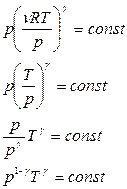 .
.
Возведем в степень 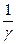
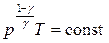 ; (6.2.4)
; (6.2.4)
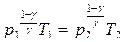 .
.
Значения const в равенствах (6.2.2) – (6.2.4) различны, эти уравнения относятся только к квазистатическому адиабатному процессу, так как во всех рассуждениях мы предполагаем, что в каждый данный момент времени состояние газа характеризуется определенными значениями параметров p,V и Т. Иными словами, рассматриваемый адиабатный процесс является обратимым. Как мы знаем, обратимым может быть только процесс, протекающий очень медленно. Но в природе близкими к адиабатному могут быть только быстро протекающие процессы. Примером такого процесса могут служить сжатия и расширения в достаточно малых объемах газа при распространении звуковой волны. Несмотря на то, что в пределах большого объема состояние газа не является равновесным (p и Т различны в разных точках пространства), поведение газа в пределах каждого малого объема можно считать адиабатным и описывать уравнением адиабаты.
Дата добавления: 2019-09-13; просмотров: 198; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
