Уравнение состояния идеального газа
Из известных в настоящее время состояний вещества – твердое, жидкое, газообразное, плазменное – наиболее простым для изучения является газообразное. Для изучения основных закономерностей этого состояния вводится понятие идеального газа.
Идеальный газ – это теоретическая модель газа, в которой:
- молекулы считаются материальными точками, неимеющими размеров, но обладающие массой;
- между молекулами отсутствуют силы взаимодействия, а следовательно, их потенциальная энергия считается равной нулю;
- молекулы идеального газа находятся в непрерывном хаотическом движении и, следовательно, обладают кинетической энергией;
- при столкновении молекулы соударяются друг с другом и со стенками сосуда по законам абсолютно упругого удара;
- движение молекул подчиняется законам Ньютона.
Идеальный газ является теоретической моделью, вводимой для упрощения рассуждений, тем не менее, реальные газы при низких давлениях и комнатных температурах по своим свойствам близки к идеальному газу.
Кроме того, внеся поправки, учитывающие собственный объем молекул газа и действующие молекулярные силы, можно перейти к теории реальных газов.
Опыт показывает, что параметры давление, объем и температура закономерно связаны друг с другом, так, что изменение одного из них влечет за собой изменение другого. Эту функциональную зависимость можно выразить аналитическим уравнением, которое называется уравнением состояния идеального газа:
 . (1.4.1)
. (1.4.1)
Французский физик и инженер Б. Клапейрон вывел уравнение состояния идеального газа, объединив законы Бойля-Мариотта и Гей-Люссака. Поэтому уравнение (1.4.1) - это уравнение Клапейрона. Оно читается следующим образом: для данной массы m идеального газа отношение произведения численных значений давления и объема к абсолютной температуре есть величина постоянная.
Численное значение постоянной в (1.4.1) зависит от количества взятого газа и от выбора единицы измерения параметров р, V , T.
Д.И. Менделеев (1874 г.) применил к уравнению Клапейрона закон Авогадро в следующей формулировке: при одинаковой температуре и давлении в одинаковых объемах идеального газа содержится одно и то же число молекул.
Отсюда следует, что в случае, когда количество газа равно одному молю, величина константы в уравнении (1.4.1) будет одинакова для всех газов. Обозначив эту константу буквой R и объем одного моля газа через  , уравнение (1.4.1) запишется следующим образом:
, уравнение (1.4.1) запишется следующим образом:
 . (1.4.2)
. (1.4.2)
Величина R называется универсальной газовой постоянной. Численное значение R можно получить из закона Авогадро: моль любого газа при одинаковой температуре и давлении занимает одинаковый объем.
При нормальных условиях, т.е. при 0 0С  и p0 = 1 атм = =760 мм рт. ст. =
и p0 = 1 атм = =760 мм рт. ст. =  Па объём одного моля любого газа занимает объём
Па объём одного моля любого газа занимает объём  м2/моль =
м2/моль =  м3/моль.
м3/моль.
Тогда согласно соотношению (1.4.2):
 Дж/моль.К.
Дж/моль.К.
Умножим левую и правую часть равенства (1.3.2) на количество вещества:
 ,
,
но объем произвольного количества газа  . Тогда
. Тогда
 .
.
Так как 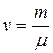 , то
, то
 . (1.4.3)
. (1.4.3)
Уравнение (1.4.3) представляет собой уравнение состояния идеального газа, называемое уравнением Менделеева – Клапейрона.
Число молекул N в данной массе газа m:

т.е.  ,
,
где  - концентрация молекул;
- концентрация молекул;
 Дж/К – постоянная Больцмана.
Дж/К – постоянная Больцмана.
Т.о, получили уравнение состояния идеального газа. Переписав уравнение в другом виде:  получим соотношение, устанавливающее связь между давлением и концентрацией газа.
получим соотношение, устанавливающее связь между давлением и концентрацией газа.
Как видно из формулы, с увеличением давления концентрация газа при данной температуре увеличивается, а с увеличением температуры при постоянном давлении концентрация уменьшается.
Опытным путем задолго до появления молекулярно-кинетической теории был открыт целый ряд законов, которые мы и рассмотрим.
Процессы, протекающие при каком-либо постоянном термодинамическом параметре, а так же массе и молярной массе вещества, называется изопроцессом.
Изотермический процесс (греч. «изос» - «одинаковый», «термо» - «тепло») – это процесс, протекающий при постоянной температуре, массе и молярной массе вещества.
Закон Бойля – Мариотта: для данной массы газа при постоянной температуре произведение давления газа на его объём есть величина постоянная:
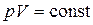
 при, (1.4.4)
при, (1.4.4)
 .
.
Кривая, изображающая зависимость между давлением и объемом при T = const, называется изотермой.
Изотермы представляют собой гиперболы, расположенные на графике тем выше, чем выше температура при которой происходит процесс (рис. 1.4.1).

Считалось, что закон (1.4.4) в 1662 г. открыл английский физик Бойль, на самом деле он был установлен в 1653 г. двумя англичанами – Ричардом Таунли и Генри Пауэром. Спустя 14 лет независимо от Бойля наиболее полное и убедительное подтверждение этому закону дал французский физик Эдм Мариотт. Сейчас в англоязычных странах закон носит имя одного Бойля, во Франции – Мариотта.
Изобарный процесс (греч. «барос» - «тяжесть») – это процесс, протекающий при постоянном давлении, массе и молярной массе вещества.
Изобарный процесс описывается законом Гей-Люссака: для данной массы газа отношение объема и температуры постоянно, если давление газа не изменяется:
 = const при
= const при 
 ,
,
 =
= 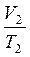 .
.
Изобара – график зависимости между параметрами состояния данной массы газа при постоянном давлении (рис. 1.4.2).
|

Изохорный процесс (греч. «хора» - занимаемое место) – это процесс, протекающий при постоянном объеме, массе и молярной массе вещества.
Изохорный процесс описывается законом Шарля: для данной массы газа отношение давления к температуре постоянно, если объем не изменяется:
 = const при
= const при 
 ,
,
 =
=  .
.
 |
Изохора - график зависимости между параметрами состояния данной массы газа при постоянном давлении(рис. 1.4.3).
 |
Дата добавления: 2019-09-13; просмотров: 165; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
