Примеры решения типовых задач
Задача 1. Вычислить [Н+], [ОН-] и рН раствора, образовавшегося в результате смешивания 30 мл 0,1М раствора уксусной кислоты СН3СООН и 50 мл 0,3М раствора ацетата калия СН3СООК.
Решение:
1. Общий объем образовавшегося раствора образовавшегося в результате смешивания Vобщ= 30 + 50= 80 мл.
2. Концентрации уксусной кислоты и ацетата калия после смешивания
[СН3СООН] =  моль/л,
моль/л,
[СН3СООК] = 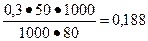 моль/л.
моль/л.
Так как ионы водорода образуются только за счет диссоциации уксусной кислоты, а ацетат анионы также и за счет диссоциации ацетата калия, то, принимая количество диссоцированной кислоты за Х, получим:
[СН3СООН]ост = (0,0375 – Х) моль/л; [Н+]= Х моль/л;
[СН3СОО-] = (0,188+ Х ) моль/л.
Из уравнения КHan =  ; 1,74
; 1,74  10-5 =
10-5 = 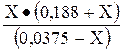
Так как Х<< 0,0375 то им можно пренебречь.
Тогда Х = [H+] = 3,5  10-6 моль/л; [OH-] = 2,85
10-6 моль/л; [OH-] = 2,85  10-9 моль/л;
10-9 моль/л;
рН= – lg (3,5  10-6) = 5,46.
10-6) = 5,46.
Такой же результат может быть получен, если пользоваться уравнением 1.
рН = рКНА – lg  = – lg (1,74
= – lg (1,74  10-5) – lg
10-5) – lg  = 4,76 – (– 0,7) = 5,46.
= 4,76 – (– 0,7) = 5,46.
Ответ: [H+] = 3,5  10-6 моль/л; [OH-] = 2,85
10-6 моль/л; [OH-] = 2,85  10-9 моль/л; рН = 5,46.
10-9 моль/л; рН = 5,46.
Пример 2. Определить рН раствора, получившегося в результате смешения равных объемов растворов 0,12М СН3СООН и СН3СООК.
Ответ. После смешения Скис= Ссоль= 0,12/2=0,06 моль/л.
Пользуясь уравнением рН = рКНА - lg  = –lg (1,74
= –lg (1,74  10-5 ) – lg
10-5 ) – lg  =
=
= 4,76 – lg1 = 4,76 - 0 = 4,76.
Ответ: рН = 4,76
Пример 3. Сколько миллилитров 0,25м раствора ацетата калия СН3СООК следует прибавить к 50 мл 1,0 м раствора уксусной кислоты СН3СООН, чтобы получить буферную систему с рН=3,0?
|
|
|
Ответ: Подставим соответствующие значения в формулу:
рН = рКНА – lg  ;
;
lg  = рКНА – рН = 4,76 – 3= 1,76;
= рКНА – рН = 4,76 – 3= 1,76;
 = 101,76 = 57,5.
= 101,76 = 57,5.
Это означает, что после смешения растворов в полученном растворе концентрация кислоты в 57,5 раза должна быть выше, чем концентрация соли. С растворе имеется 0,05  1,0 = 0,05 моль кислоты. Следовательно, количество вещества соли в этом растворе должно быть в 57,5 раза меньше, а именно 0,05:57,5=0,00087 моль ацетата калия.
1,0 = 0,05 моль кислоты. Следовательно, количество вещества соли в этом растворе должно быть в 57,5 раза меньше, а именно 0,05:57,5=0,00087 моль ацетата калия.
V=0,00087/ 0,25 = 0,00348л = 3,48 мл.
Ответ: V = 3,48 мл.
Задача 4. Буферная система, состоящая из дигидрофосфата калия КН2РО4 и гидрофосфата калия К2НРО4 приготовлена при мольном соотношении солей 16 : 1. Определить рН данного раствора.
Решение: В данном случае кислотой является КН2РО4, то есть кислота Н2РО4- (из таблицы К2= 6,2  10-8 или рК = 7,2).
10-8 или рК = 7,2).
Используя уравнение рН = рКНА – lg, получим: рН = 7,2 – lg16= 6,0
Ответ: рН = 6.
Задача 5. Вычислить рН буферного раствора, содержащего 0,2 М NH4Cl и 0,2 М NH4OH.
В соответствии с уравнением 2,
рН=14 – рКВОН + lg  .
.
Так как рК (NH4ОН) = 4,755, то
рН = 14 – 4,755 + lg 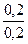 = 9,25 .
= 9,25 .
Ответ: рН = 9,25.
Жёсткость воды
Теоретические пояснения
Природная вода в своем составе всегда содержит различные примеси- соли и газы, механические примеси, находящиеся во взвешенном состоянии, эмульсии, гидрозоли и другие коллоидные образования и т.п. Соли, присутствующие в воде, вызывают жесткость воды.
|
|
|
Гидрокарбонаты кальция и магния обуславливают карбонатную жесткость. При нагревании воды растворенные гидрокарбонаты разлагаются, и карбонатная жесткость при этом сильно снижается. Полного устранения карбонатной жесткости не происходит вследствие того, что карбонат кальция, и особенно магния несколько растворим в воде.
Наряду с понятием «карбонатная жесткость», существует еще понятие об устранимой жесткости, на которую она понижается при десятиминутном кипячении воды. Жесткость, оставшаяся после кипячения воды, называется постоянной жесткостью.
Хлориды и сульфаты кальция и магния обуславливают некарбонатную жесткость воды. Сумма карбонатной и некарбонатной жесткости составляет общую жесткость. Жесткость выражают в виде суммы миллимоль-эквивалентов ионов кальция и магния, содержащихся в 1 л воды. 1 ммоль-экв (ммоль/л) жесткости отвечает содержанию 20,04 мг/л Са2+ или 12,16 мг/л Mg2+.
Различают очень мягкие, мягкие, средне жесткие, довольно жесткие, жесткие и очень жесткие воды. Один литр мягкой воды содержит 1,5-3,0 ммоль-экв, а жесткой 6,5-11,0 ммоль-экв Са2+.
|
|
|
Жесткость воды определяется аналитически.
Карбонатную (устранимую или временную) жесткость воды определяют титрованием воды соляной кислотой:
Са(НСО3)2 + 2НС1 = CaCl2 + 2H2O + 2СO2 (8.1)
Mg(HCO3)2 + 2НС1 = MgCl2 + 2Н2О + 2СО2 (8.2)
Точку эквивалентности можно определить или потенциометрическм титрованием с помощью рН-метра (определение объема раствора соляной кислоты в точке скачка рН) или титрованием в присутствии кислотно-основных индикаторов (чаще всего метилового-оранжевого).
Для выбора соответствующего кислотно-основного индикатора необходимо строить интегральную кривую титрования, исходя из показателей потенциометрического титрования. После определения значения рН-скачка подбирается соответствующий индикатор, исходя из его физико-химических показателей.
Таблица 8.1 – Характеристика наиболее часто применяемых кислотно-основных индикаторов.
| № | И н д и к а т о р | Интервал перехода рН | Изменение окраски раствора при возрастании рН |
| 1 | О-крезоловый синий | 0,2 - 1,9 | красная  желтая желтая
|
| 2 | Тимоловый синий | 1,2 – 2,8 | красная  желтая желтая
|
| 3 | Метиловый оранжевый | 3,1 – 4,4 | красная  оранжевая оранжевая
|
| 4 | Бромкрезоловый зеленый | 3,8 – 5,4 | желтая  синяя синяя
|
| 5 | Бромметиловый зеленый | 5,0 – 8,0 | желтая  синяя синяя
|
| 6 | Лакмус | 5,0 –8,0 | красна  синяя синяя
|
| 7 | Бромтимоловый синий | 6,0 – 7,6 | желтая  синяя синяя
|
| 8 | Феноловый красный | 6,8 – 8,4 | желтая  красная красная
|
| 9 | Фенолфталеин | 8,0 – 9,6 | бесцветная  красная красная
|
| 10 | Ализариновый желтый | 10,0 – 12,0 | бледно-лимон.  желтый желтый
|
Некарбонатную (постоянную) жесткость воды определяют методом обратного титрования. К отмеренному объему исследуемой воды добавляют определенный объем раствора карбоната натрия известной концентрации и выпаривают раствор досуха. При этом образуются нерастворимые в воде карбонаты кальция и магния.
|
|
|
Са2+ + Mg2+ + 2Na2CO3 = CaCO3  + MgCO3
+ MgCO3  + 4Na+ (8.3)
+ 4Na+ (8.3)
Сухой остаток, представляющий из себя смесь карбонатов кальция, магния, натрия и других солей натрия, растворяют в не содержащей СО2 воде, отфильтровывают нерастворимые в воде карбонаты кальция и магния и титрометрическим способом определяют в растворе количество избыточного Na2CO3, не вошедшего в реакцию осаждения карбонатов. Специальными опытами показано, что при этом Na2CO3 не реагирует с гидрокарбонатами кальция и магния. Именно поэтому, этот метод позволяет определять постоянную жесткость воды.
Общую жесткость определяют как сумму постоянной и временной (карбонатной) жесткости.
Современным методом определения общей жесткости воды является титрование воды раствором трилона Б в присутствии специальных индикаторов- хромогенов, чаще всего эрихрома черного. Титрование проводится в аммиачной среде при значении рН раствора в пределах 9-10.
Хромогены образуют с ионами магния и другими ионами относительно непрочные комплексные соединения, окрашенные в красно-фиолетовый цвет. При титровании трилоном Б, содержащиеся в воде ионы Са2+ и Mg2+, а также ионы Cu2+, Zn2+, Mn2+, Cd2+, Ni2+, Al3+, Fе2+, Fe3+ реагируют с ним и образуют мало диссоциированные бесцветные прочные комплексные соединения. В конце титрования ионы магния, кальция и другие переходят от комплексного соединения с хромогеном к трилону Б, с образованием прочных, бесцветных комплексов. Трилон-Б или комплексон III - динатриевая соль этилендиамминтетрауксусной кислоты (NaO2CCH2)2N(CH2)2N(CH2CO2H)2 или сокращенно-(Na2H2ЭДТА).
Na 2 H 2 ЭДТА + Са2+ (или Mg 2+ )  Na 2 Ca ЭДТА + 2H+. (8.4)
Na 2 Ca ЭДТА + 2H+. (8.4)
Поэтому, в точке эквивалентности, красно-фиолетовая окраска раствора исчезает. Однако раствор не обесцвечивается, а окрашивается в сине-фиолетовый цвет - цвет самого хромогена - эрихрома при рН = 9-10 (аммиачный буфер), что указывает на окончание титрования.
Так как трилон-Б образует прочные комплексы со всеми катионами кальция и магния, вне зависимости от характера аниона, поэтому комплексометрическим методом определяют именно общую жесткость воды.
Проба воды должна характеризовать действительный ее состав, поэтому при отборе пробы из водопровода воду спускают в течение 10-15 мин. Когда склянка наполнится, воду некоторое время переливают через край.
Из рек и ручьев отбирают пробы воды на глубине 0,75 м в нескольких местах, около берегов и в середине реки. Отдельные пробы смешивают вместе. Анализ воды проводят сразу же после взятия пробы или, в крайнем случае, при соответствующем хранении спустя несколько часов.
Карбонатную жесткость воды определяют кислотно-основным титрованием анализируемой воды. Для этого оттитровывают воду в колбе 0,1н раствором НСl. С помощью рН-метра фиксируют значения рН воды после каждого раза прибавления по 0,5мл кислоты из бюретки, строят интегральную и дифференциальные кривые титрования. Из кривых титрования определяют точку эквивалентности. Пользуясь данными табл.1 выбирают соответствующий индикатор для экспресс анализа.
Карбонатную жесткость воды (Жврем, ммоль/л) определяют по формуле:
Жврем = 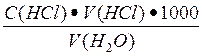 (8.5)
(8.5)
где V(HCl) – объем раствора НСl концентрацией С(HCl), израсходованного до точки эквивалентности;
V(Н2О) – объем исследуемой воды.
Общую жесткость воды определяют комплексометрическим титрованием. В коническую колбу отмеряют пипеткой соответствующее количество исследуемой воды (100-150 мл), добавляют 5 мл аммиачного буфера, несколько кристаллов эрихрома, до образования заметной вишнево-красной окраски. При слабой окраске универсальной индикаторной бумагой проверяют рН раствора. Он должен соответствовать значениям 8-11. При необходимости корректируют рН добавлением в раствор буферной смеси.
Раствор оттитровывают стандартным раствором трилона-Б, до точки резкого перехода вишнево - красной окраски в синюю. Окраска раствора от избытка трилона-Б остается неизменной, поэтому в конце титрования рабочий раствор трилона прибавляют по каплям, энергично перемешивая. Титрование повторить два раза и взять среднее значение объема израсходованного раствора трилона.
Общую жесткость воды Жобщ (ммоль/л), определить по формуле:
Жобщ =  ; (8.6)
; (8.6)
где V1 – объем рабочего раствора трилона - Б на титрование пробы воды,
объемом V2,
N – молярная концентрация эквивалента рабочего раствора трилона Б,
моль/л.
По разности значений общей и карбонатной жёсткости определяют постоянную жесткость.
Жесткая вода обладает рядом качеств, которые делают ее непригодной в производственных процессах. В жесткой воде мыла и стиральные порошки плохо пенятся, что приводит к перерасходу их в процессах стирки и мойки оборудования и деталей. В паровых котлах и компрессорах во время их эксплуатации образуется накипь- отложение мраморного слоя на стенках металла, что часто приводит к аварии или взрывам.
Умягчение воды проводится с целью предотвращения образования в паровых котлах и теплообменных аппаратах накипи и для экономии стиральных средств в процессах стирки и мойки.
Жесткость воды чаще всего устраняется при помощи ионитов и известково-содовым методом. Другие методы находят более ограниченное применение в виду их нерентабельности (высокая стоимость и трудоемкость).
Умягчение воды может быть достигнуто:
1) осаждением иона кальция (обычно совместно с ионом магния) и последующим удалением осадка;
2) удалением иона кальция (и магния) методом ионного обмена.
Метод ионного обмена основан на способности ионитов поглощать из растворов одни ионы и отдавать взамен другие. Иониты, способные обменивать находящиеся в растворе катионы, называются катионитами. К катионитам относятся: алюмосиликаты, сульфированные угли, синтетические смолы. Характерной особенностью катионитов является наличие в них большого числа кислотных групп: силикатных, карбоксильных и сульфогрупп. Эти кислотные группы содержат ионы водорода, которые подвижны и могут быть заменены на различные катионы (R-SO2OH + Me+  R-SO2OMe + H+).
R-SO2OMe + H+).
Иониты, обменивающие анионы с находившимися в растворе ионами солей и кислот, называются анионитами. Аниониты представляют собой аминосмолы, содержащие амино (-NH2) и имино (-NH) группы. Способность этих групп образовывать соли с различными анионами и используется для анионного обмена:
R-NH2 + HOH  [R-NH3]+OH- (8.7)
[R-NH3]+OH- (8.7)
[R-NH3]+OH- + А-  [R-NH3]+ A- + OH- (8.8)
[R-NH3]+ A- + OH- (8.8)
Для умягчения воды применяются обычно катиониты в водородной (Н-катиониты) и натриевой (Na-катиониты) форме. Если обозначить весь катионит, кроме подвижного иона (например, натрия), буквой R, то реакции ионного обмена в жесткой воде (содержащей ионы кальция и магния) могут быть выражены следующими уравнениями:
Na2R + (Са,Mg) (НСО3)2  (Са, Mg)R + 2NаНСО3 (8.9)
(Са, Mg)R + 2NаНСО3 (8.9)
Na2R + (Са,Mg) SO4  (Са, Mg)R + Na2SO4 (8.10)
(Са, Mg)R + Na2SO4 (8.10)
Na2R + (Са, Mg)Cl2  (Са, Mg)R + 2NaCl (8.11)
(Са, Mg)R + 2NaCl (8.11)
Количество катионов кальция и магния, которое может быть поглощено определенным количеством катионита, называется емкостью поглощения Е и выражается в моль эквивалентах на 1 м3 ионита. Например, емкость поглощения сульфоугля равна 1000 моль экв/м3; эспатита -1700 моль экв/м3; алюмосиликатов - 850 моль экв/м3.
После длительной работы иониты насыщаются и теряют свои эксплуатационные качества. С целью возобновления работы ионита их подвергают процессу регенерации.
Для регенерации катионитов натрия на кальций, ионит регенерируют, т. е. пропускают через него насыщенный раствор хлорида натрия. При этом ионы кальция вытесняются ионами натрия.
Другой распространенный способ умягчения воды - известково-содовый. Для очистки воды по известково-содовому методу используют смесь соды и гашеной извести. При действии извести соли, дающие карбонатную жесткость, и растворенный в воде оксид углерода (IV) переводятся в осадок:
Са(НСО3)2 + Са(ОН)2  2СаСО3
2СаСО3  + 2Н2O (8.12)
+ 2Н2O (8.12)
Mg(НСО3)2 + Са(ОН)2  MgCO3
MgCO3  + СаСО3 + 2Н2O (8.13)
+ СаСО3 + 2Н2O (8.13)
СО2 + Са(ОН)2  СаСО3
СаСО3  + Н2О (8.14)
+ Н2О (8.14)
Одновременно магниевая жесткость заменяется на кальциевую, так как образовавшийся в качестве продукта ионного обмена гидроксид магния в воде растворим хуже, чем гидроксид кальция:
MgCl2 + Са(ОН)2  Mg(OH)2
Mg(OH)2  + CaСl2 (8.15)
+ CaСl2 (8.15)
Содой удаляют соли, обусловливающие наличие некарбонатной жесткости:
CaSO4 + Nа2СО3  СаСО3
СаСО3  + Na2SO4 (8.16)
+ Na2SO4 (8.16)
CaCI2 + Na2CO3  СаСО3
СаСО3  + 2NaCl (8.17)
+ 2NaCl (8.17)
Карбонаты выпадают в виде взвеси. После фильтрования вода содержит соли, не дающие накипи, поэтому вполне пригодна для многих промышленных целей.
В последние годы все большее значение приобретает метод удаления солей с помощью постоянного электрического тока, называемый электродиализом. Этот метод оказался более экономичным по сравнению с ионообменным.
Принцип метода заключается в следующем (рисунок 8.1).

1,2 - катодное и анодное пространства; 3 - межэлектродное пространство (обессоливаемая вода); 4, 5 - катодная и анодная мембраны; 6,7- катод и анод.
Рисунок 8.1 – Схема обессоливания воды электродиализом
Если через воду, находящуюся в ванне, разделенной полупроницаемыми диафрагмами на три отделения, пропускать постоянный электрический ток, то при соответствующем напряжении будет происходить электролиз растворенных солей. Катионы из анодного пространства и из средней камеры под действием электрического поля перемещаются в катодное пространство, где накапливается раствор гидроксидов натрия, калия, магния и др.
Анионы, в свою очередь, из катодного пространства и из средней камеры перемещаются в анодное пространство, где накапливаются кислоты – соляная и серная. На катоде происходит разрядка ионов водорода и выделение водорода.
На аноде выделяется кислород и частично хлор за счет разрядки молекул воды, а частично гидроксид-ионов, а также хлорид-ионов. По мере прохождения электролиза в средней камере количество катионов и анионов кислот уменьшается и получается обессоленная вода. Загрязненную солями воду из катодного и анодного пространства выливают, поскольку она является отходом, а из среднего пространства частично очищ6енная вода поступает в другой электродиализатор. Описанный метод применяется как для опреснения воды, например морской, используемой для бытовых нужд, так и для получения воды особой чистоты, используемой для получения ультрачистых веществ.
Дата добавления: 2019-09-08; просмотров: 479; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
