Примеры решения типовых задач
Задача 1. Определите массовую долю в (%) хлорида калия в растворе, содержащем 0,053 кг KCI в 0,5 л раствора, плотность которого 1063 кг/м3.
Решение. Массовую долю вещества находим по формуле
 %
%
где m (в-ва) – масса вещества, г;
m (р-ра) – масса раствора, г.
Масса раствора равна произведению объема раствора V на его плотность ρ
m = Vρ, тогда 
массовая доля хлорида калия в растворе равна:
 .
.
Ответ: 10%.
Задача 2. Какова масса NaOH, содержащегося в 0,2 л раствора, если молярная концентрация раствора 0,2 моль/л?
Решение. Молярную концентрацию вещества находят по формуле
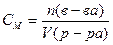
где n (в-ва) – количество вещества, моль;
V (р-ра) – объем раствора, л.
Количество вещества n вычисляют по формуле

где m – масса вещества, г;
М – молярная масса вещества, г/моль.
Тогда масса NaOH, содержащегося в растворе, равна

Ответ: 0,8 г.
Задача 3.Вычислите осмотическое давление раствора, содержащего в 1,4 л 63 г глюкозы C6H12O6 при 0 0С.
Решение. Осмотическое давление вычисляют по формуле
 ,
,
где ν – количество вещества, моль;
R – газовая постоянная, равная 8,314 Дж/(моль·К);
Т – абсолютная температура, К;
V – объем раствора, м3.
В 1,4 л раствора содержится 63 г глюкозы, молярная масса которой равна 180,16 г/моль. Следовательно в 1,4 л раствора содержится ν= 63/180,16=0,35 моль глюкозы. Осмотическое давление этого раствора глюкозы:

Ответ: 5,67 * 105 Па.
Задача 4. Вычислите давление пара над раствором, содержащим 34,23 г сахара C12H22O11, в 45,05 г воды при 65 0С, если давление паров воды при этой температуре равно 2,5•104 Па.
|
|
|
Решение. Давление пара над раствором нелетучего вещества в растворителе всегда ниже давления пара над чистым растворителем при той же температуре. Относительное понижение давления пара растворителя над раствором согласно закону Рауля выражается соотношением
 ,
,
где P 0 – давление пара над чистым растворителем;
P – давление пара растворителя над раствором;
n – количество растворенного вещества, моль;
N – количество растворителя, моль.
М(C12H22O11)=342,3 г/моль;
М(H2O)=18,02 г/моль.
Давление пара над раствором:
 Па
Па
Ответ: 2,4 * 104 Па.
Задача 5. Раствор камфоры массой 0,552 г в 17 г эфира кипит при температуре на 0,4610 выше, чем чистый эфир. Эбулиоскопическая константа эфира 2,16 0С. Определите молярную массу камфоры.
Решение. Молекулярную массу камфоры определяем пользуясь соотношением

Ответ: Молекулярная масса камфоры равна 155,14 г/моль.
Задача 6. В каком отношении должны находиться массы воды и этилового спирта, чтобы при их смешении получить раствор, кристаллизующийся при –200С?
Решение: В соответствии со следствием из закона Рауля, понижение температуры замерзания раствора пропорционально моляльной концентрации растворенного неэлектролита:
|
|
|

По условию задачи  . Зная криоскопическую постоянную воды (1,86
. Зная криоскопическую постоянную воды (1,86  ), можно найти моляльную концентрацию раствора этилового спирта:
), можно найти моляльную концентрацию раствора этилового спирта:

Иными словами в одном килограмме воды содержится 10,75 моль этилового спирта, масса которого равна:

Отношение масс воды и этилового спирта равно:
1000:494,5 = 2:1
Ответ: Отношение масс воды и этилового спирта 2:1.
Задача 7. В радиатор автомобиля налили 9 л воды и прибавили 2 л метанола (плотность 0,8 г/мл). При какой температуре можно после этого оставлять автомобиль на открытом воздухе, не опасаясь, что вода в радиаторе замерзнет?
Решение: В соответствии со следствием из закона Рауля, понижение температуры замерзания раствора пропорционально моляльной концентрации растворенного неэлектролита:
 или
или 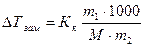
Принимая во внимание, что плотность воды близка к 1 г/мл, а плотность метанола равна 0,8 г/мл, можно от объемов перейти к массам:

Учитывая, что 
 , а
, а  имеем:
имеем: 
Таким образом, вода в радиаторе будет замерзать при температуре -5,55  , поэтому автомобиль не рекомендуется оставлять на открытом воздухе при данной и более низких температурах.
, поэтому автомобиль не рекомендуется оставлять на открытом воздухе при данной и более низких температурах.
|
|
|
Ответ: 5,55 0С.
Задача 8. При какой температуре замерзнет раствор, состоящий из 40% (объемных) раствор этанола и 60% воды. Плотность этанола принять за 0,8г/см3. Плотность раствора принять за 0,94г/см3.
Решение. Воспользуемся уравнением 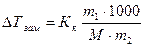 . Допустим, имеем 100 мл или 100
. Допустим, имеем 100 мл или 100  0,94=94 грамм раствора. В этом объеме содержится 40 мл (или 40
0,94=94 грамм раствора. В этом объеме содержится 40 мл (или 40  0,8=32г) этанола, с молярной массой 46г/моль.Таким образом, в 100мл раствора содержится 32г этанола и 94-32=62г воды. Подставим эти значения в уравнение.
0,8=32г) этанола, с молярной массой 46г/моль.Таким образом, в 100мл раствора содержится 32г этанола и 94-32=62г воды. Подставим эти значения в уравнение.

Таким образом, раствор может замерзать при температуре окружающей среды ниже -20,86оС.
Ответ: -20,86оС.
Задача 9. Вычислите растворимость BaCl2 в воде при 0 0С, если при этой температуре в 13,1 г раствора содержится 3,1 г BaCl2.
Решение. Растворимость (или коэффициент растворимости) выражают массой вещества, которое можно растворить в 100 г воды при данной температуре. Масса раствора BaCl2 13,1 г. следовательно, в 10 г растворителя при 0 0С содержится 3,1 г BaCl2. растворимость BaCl2 при 0 0С равна 100·3,1/10=31 г.
Ответ: 31 г.
Задача 10. Растворимость Ag3PO4 (Mч=418,58) в воде при 20 0С равна 0,0065 г/л. Рассчитайте значение произведения растворимости.
Решение. Растворимость Ag3PO4 равна
 моль/л.
моль/л.
При диссоциации 1 моль Ag3PO4 образуется 3 моль ионов Ag+ и 1 моль ионов PO43-, поэтому концентрация иона PO43- равна растворимости Ag3PO4, а концентрация иона Ag+ в 3 раза больше, т.е.
|
|
|
С(PO43-)= 1,6·10-5 моль/л; С(Ag+)= 3·1,6·10-5 моль/л.
Произведение растворимости Ag3PO4 равно
ПР=С3(Ag+)· С(PO43-)=(4,8·10-5)3·1,6·10-5=1,77·10-18.
Ответ: 1,77 * 10-18
Задача 11. Рассчитать концентрации катионов кальция и фосфат анионов в насыщенный растворе отрофосфата кальция Са3(РО4)3, если ПР[Са3(РО4)2]= 10-29?
Решение: Мало растворимая соль ортофосфат кальция в воде слабо диссоцирует:
Са3(РО4)2  3Са2+ + 2РО43-
3Са2+ + 2РО43-
ПР[Са3(РО4)2 ] = [Са2+]3  [РО43-]2 = 10-29
[РО43-]2 = 10-29
Допустим, в одном литре насыщенного раствора этой соли диссоциации подверглась Х моль фосфата кальция. При этом, образовались 3Х моль катионов кальция и 2Х моль фосфат анионов. Подставим эти значения в выражении ПР.
ПР[Са3(РО4)2 ] = [3Х]3  [2Х]2 = 108Х5 = 10-29;
[2Х]2 = 108Х5 = 10-29;
Х=  моль.
моль.
Таким образом, в насыщенном растворе [Ca2+]= 3  0,7
0,7  10-6=2,1
10-6=2,1  10-6 моль/л, и [PO43-] = 2
10-6 моль/л, и [PO43-] = 2  0,7
0,7  10-6 = 1,4
10-6 = 1,4  10-6моль/л.
10-6моль/л.
Ответ: [Ca2+]=2,1  10-6 моль/л, [PO43-] =1,4
10-6 моль/л, [PO43-] =1,4  10-6моль/л.
10-6моль/л.
Задача 12. Образуется ли осадок ортофосфата кальция при смешении по одному литру растворов ортофосфата натрия, концентрации 2  10-4 моль/л и хлорида кальция, концентрацией 2
10-4 моль/л и хлорида кальция, концентрацией 2  10-3моль/л.
10-3моль/л.
Решение: При смешении по одному литра двух растворов объем нового раствора удвоится, следовательно концентрации солей в этом растворе уменьшатся в 2 раза. Таким образом, в новом растворе имеем: [Ca2+]= 10-3 моль/л и [PO43-] = 10-4 моль/л.
Произведение ионов в новом растворе будет:
ИП [Са3(РО4)2 ] = [Са2+]3  [РО43-]2 = (10-3)3
[РО43-]2 = (10-3)3  (10-4)2= 10-17
(10-4)2= 10-17
Осадок может быт образован при случи, когда ИП по значению оказывается больше, чем ПР. Так как ПР[Са3(РО4)2 ] = 10-29, а ИП= 10-17, то осадок выпадет, так как в рассмотренном случае ПИ > ПР.
Ответ: ПИ > ПР, осадок выпадает.
Водородный показатель среды
Теоретические пояснения
Водородный показатель среды водного раствора электролита рН равен взятому с обратным знаком десятичному логарифму активности ионов водорода в этом растворе:
рН = –lg ан + (6.1)
Среда водного раствора электролита может быть: кислой, нейтральной или щелочной.
Носителями кислотных свойств являются ионы Н+, а основных – ион ОН–, поэтому в кислых растворах ан + > аон-, а в щелочных – ан +< аон-.
Растворы, в которых ан + = аон- называют нейтральными.
При электролитической диссоциации воды образуется равное количество ионов H+ и ОН–:
2Н2О 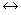 Н3О+ + ОН– ,
Н3О+ + ОН– ,
или упрощенно:
Н2О  Н+ + ОН–.
Н+ + ОН–.
Константа диссоциации воды (Кд) при 250С (295 К) равна 1,8  10-16, а активность (концентрация) воды при той же температуре
10-16, а активность (концентрация) воды при той же температуре  моль/л.
моль/л.
Тогда КД = 
 = 1,8 х10-16 ,
= 1,8 х10-16 ,
отсюда ан +  аон- = 1,8 10-16 х 55,56 = 10-14 .
аон- = 1,8 10-16 х 55,56 = 10-14 .
Величина KW = ан +  аон- называется ионным произведением воды (буква w от англ. слова water - вода). При 295К она составляет 10-14.
аон- называется ионным произведением воды (буква w от англ. слова water - вода). При 295К она составляет 10-14.
В нейтральных растворах активность ионов водорода равна активности гидроксо-групп: ан + = аон- =  = 10-7 моль/л.
= 10-7 моль/л.
Следовательно, в:
· нейтральной среде рН= –lg ан + = –lg 10–7= 7,
· кислой среде ан + >10–7 моль/л, то и рН < 7,
· щелочной среде ан + < 7 моль/л и рН > 7.
Наряду с показателем рН используется показатель рОН:
рОН = –lg аон- . (6.2)
Из выражения KW =10-14, при 295К можно показать, что
– lg KW = –lg ан+ = –lg аон–, следовательно
рН + рОН = 14.
При расчете водородного показателя среды водных растворов сильных кислот и оснований следует учитывать необратимость процесса их электролитической диссоциации, то есть степень диссоциации 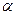 = 1:
= 1:
НС1  Н+ + Сl– и NaOH
Н+ + Сl– и NaOH  Na+ + ОН–.
Na+ + ОН–.
Концентрация ионов Н+ в растворах сильных кислот и концентрация ионов ОН- в растворах щелочей численно равны молярной концентрации (молярности) растворов. Например, CН+ в 0,001 М растворе НС1 равна 0,001 моль/л, а СОН- в 0,01 М растворе NaOH равна 0,01 моль/л.
Чтобы вычислить значение водородного или гидроксильного показателя среды (рН или рОН), нужно знать активность ионов H+ или ОН- (ан + или аон-). ан + = f  CH+ и аон- = f
CH+ и аон- = f  СОН- . Коэффициенты активности ионов находят по справочным таблицам как функцию ионной силы раствора.
СОН- . Коэффициенты активности ионов находят по справочным таблицам как функцию ионной силы раствора.
Более подробная информация представлена в примерах решения задач.
Дата добавления: 2019-09-08; просмотров: 289; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
