Пример 1. Приведение объема газа к нормальным условиям.
Какой объем (н.у.) займут 0,4·10-3 м3 газа, находящиеся при 50 0С и давлении 0,954·105 Па?
Решение. Для приведения объема газа к нормальным условиям пользуются общей формулой, объединяющей законы Бойля-Мариотта и Гей-Люссака: 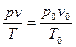
Объем газа (н.у.) равен 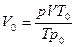 , где Т0=273 К; P 0=1,013·105 Па; Т=273+50=323 К.
, где Т0=273 К; P 0=1,013·105 Па; Т=273+50=323 К.
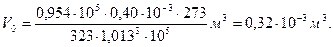
Пример 2. Определение средней молекулярной массы смеси газов по относительной плотности.
Вычислите среднюю молекулярную массу смеси газов, состоящей на 80% из метана и 20% кислорода (по объему), используя значения относительной плотности этих газов по водороду.
Решение. Часто вычисления производят по правилу смешения, которое заключается в том, что отношение объемов газов в двухкомпонентной газовой смеси обратно пропорционально разностям между плотностью смеси и плотностями газов, составляющих эту смесь. Обозначим относительную плотность газов через 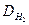 . Она будет больше плотности метана, но меньше плотности кислорода:
. Она будет больше плотности метана, но меньше плотности кислорода:
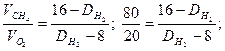
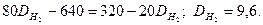
Плотность этой газовой смеси по водороду равна 9,6. средняя молекулярная масса газовой смеси  равна удвоенной ее плотности по водороду:
равна удвоенной ее плотности по водороду: 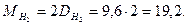
Пример 3. Определение давления газовой смеси.
В сосуде объемом 0,05 м3 при 25 0С содержится смесь из 0,020 м3 этилена под давлением 83950 Па и 0,015 м3 метана под давлением 95940 Па. Найдите общее давление газов в сосуде.
Решение. Сначала определяем парциальное давление каждого из газов:
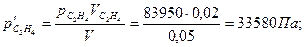 и
и 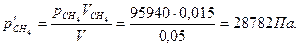
Общее давление газовой смеси равно сумме парциальных давлений ее компонентов: 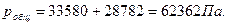
|
|
|
Пример 4. Вычисление химических эквивалентов.
На восстановление 7,09 г оксида двухвалентного металла требуется 2,24 л водорода, измеренного при (н.у.). Вычислить молярные массы металла и оксида. Чему равна относительная масса металла?
Решение. По закону эквивалентов массы веществ m 1 и m 2, вступающих в реакцию, пропорциональны молярным массам их эквивалентов 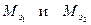
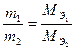 ; (1)
; (1) 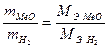 (2)
(2)
Если одно из веществ находится в газообразном состоянии, то как правило, его количество измеряется в объемных единицах (см3, л, м3).
Формулу (2) преобразуем относительно объема водорода: 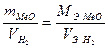
Находим молярную массу эквивалента металла (г/моль): 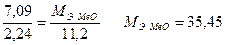
По закону эквивалентов: 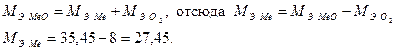
Относительную атомную массу металла определяем из соотношения:
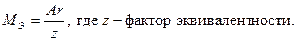
Химическая кинетика и равновесие
Теоретические пояснения
Скоростью химической реакции называют изменение концентрации реагирующего вещества в единицу времени. Её размерность моль 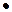 л-1
л-1  с-1. Скорость реакции определяется природой реагирующих веществ и зависит от условий протекания процесса (концентрации реагирующих веществ, температуры, наличия катализатора и др.).
с-1. Скорость реакции определяется природой реагирующих веществ и зависит от условий протекания процесса (концентрации реагирующих веществ, температуры, наличия катализатора и др.).
Зависимость скорости реакции от концентрации выражается законом действующих масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам.
|
|
|
Например, для реакции
Н2(г) + I 2 (г) 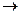 2HI(г) (4.1)
2HI(г) (4.1)
закон действующих масс может быть записан
V = kCH  CI
CI  (4.2)
(4.2)
где V – скорость химической реакции;
k– константа скорости, моль  л-1
л-1  с-1;
с-1;
CH 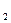 и CI
и CI 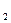 – концентрации реагирующих веществ, моль/л.
– концентрации реагирующих веществ, моль/л.
Реакции в гетерогенной системе осуществляются на поверхности раздела между фазами. Поэтому скорость гетерогенных реакций при постоянной температуре зависит не только от концентрации веществ, но и от площади поверхности раздела.
Так, для реакции сгорания кристаллического углерода в атмосфере кислорода:
С(к) + О2(г)  СО2(г), (4.3)
СО2(г), (4.3)
углерод находится в гетерогенной (твердой фазе) и его концентрация не может быть учтена в выражении скорости реакции.
Для данного примера закон действующих масс имеет вид
V = k 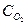 S , (4.4)
S , (4.4)
где k – константа скорости;
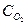 – концентрация кислорода;
– концентрация кислорода;
|
|
|
S – площадь поверхности раздела между фазами.
Дата добавления: 2019-09-08; просмотров: 2733; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
