Примеры решения типовых задач
Задача 1. Напишите уравнения реакций образования всех возможных кислых и основных солей: Fe(OH)3 + H3PO4 →
Решение: Кислые или основные соли образуются при неполной нейтрализации многоосновной кислоты (кислые) или многокислотного основания (основные).
Трехосновная отрофосфорная кислота H3PO4 может образовать три вида солей: средняя соль - ортофосфаты, с кислотным основанием PO43-, и два вида кислых солей - дигидроортофосфаты - Н2PO4- и гидроортофосфаты - НPO42-.
Трехкислотное основание гидроксид железа (III) может образовать 3 вида солей: средняя соль – с катионом железа (III) Fe3+, и два вида основных солей – с катионом гидроксожелеза (III) Fe(OH)2+ и дигидроксожелеза (III) Fe(OH)2+ .
Таким образом, теоретически можно предсказать, что могут быть образованы: 1 средняя соль, 2 вида кислых солей и 2 вида основных.
Для образования кислых солей необходимо, чтобы основание было в избытке, то есть мольное отношение  . То есть, возможны варианты
. То есть, возможны варианты  и
и  . В соответствие с этим напишем эти три уравнения.
. В соответствие с этим напишем эти три уравнения.
3Fe(OH)3 + 2H3PO4 → [Fe(OH)]3 (PO4)2 + 6H2O (2.1)
Ортофосфат гидроксожелеза (III)
3Fe(OH)3 + H3PO4 → [Fe(OH)2]3 (PO4) + 3H2O (2.1)
Ортофосфат дигидроксожелеза (III)
Для образования кислых солей необходимо, чтобы в реакционной среде кислота была в избытке. То есть, возможны варианты  и
и  . В соответствие с этим напишем эти три уравнения.
. В соответствие с этим напишем эти три уравнения.
|
|
|
2Fe(OH)3 + 3H3PO4 → Fe2 ( Н PO4)3 + 6H2O
Гидроортофосфат железа (III)
Fe(OH)3 + 3H3PO4 → Fe ( Н 2 PO4)3 + 6H2O
Дигидроортофосфат железа (III)
 H – O
H – O

 H – O – P=O H – O
H – O – P=O H – O



 O – H H – O O P=O
O – H H – O O P=O


 Fe – O – H + H – O → Fe – O + 3H2O
Fe – O – H + H – O → Fe – O + 3H2O

 O – H H – O – P=O О
O – H H – O – P=O О
 H – O H – O – P=O
H – O H – O – P=O
H – O
Если студент затрудняется в определении структуры или брутто формулы образовавшейся соли, то можно прибегнуть к схематической формы решения задачи. Рассмотрим пример образования гидроортофосфата железа (III) в дигидроортофосфат железа (III) взаимодействием одной моли Fe(OH)3 и двух молей H3PO4.
Задача 2. Имея в распоряжении только калий, воду, воздух и фосфор, получите максимальное число минеральных удобрений.
Решение.
2К + 2Н2О → 2КОН + Н2 
Воздух →N2 (78%) + О2 (21%)
N2 + 3Н2 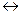 2NH3
2NH3 
N2+ O2  2NO2
2NO2
2NO + O2→ 2NO2
4NO2 + O2+ 2H2O → 4HNO3
HNO3+ NH3→ NH 4 NO 3 (нитрат аммония или аммиачная селитра)
|
|
|
4Р + 5О2 → 2Р2О5
Р2О5 + 3Н2О → 2Н3РО4
2Н3РО4 + 3NH3 → ( NH 4 )Н2РО4 + ( NH 4 )2НРО4 (аммофос)
Н3РО4 + 3КОН → 3Н2О +К3РО4 (ортофосфат калия)
КОН + HNO3→ К NO 3 (нитрат калия или калийная селитра)
Задача 3. На примере ортофосфата гидроксокальция покажите химизм последовательного перехода основной соли в кислую (дигидроортофосфата кальция). Назовите все соли.
Решение.
(СаОН)3РО4 + 2Н3РО4→ 6Н2О + Са3(РО4)2
ортофосфата гидроксокальция ортофосфата кальция
Са3(РО4)2 + Н3РО4 → 3СаНРО4
гидроортофосфат кальция
СаНРО4 + Н3РО4 → Са(Н2РО4)2
дигидроортофосфат кальция
Задача 4. Имеются отдельные пробирки с растворами хлоридов алюминия, аммония, кальция и железа (II). По каким признакам и химическими превращениями можно установить содержание каждой пробирки? Приведите уравнения химических реакций.
Решение: Отбираем некоторую часть от этих растворов и помещаем их в пронумерованные (1,2, 3 и 4) пробирки.
Ко всем 4 пробиркам по порциям добавляем раствор гидроксида натрия. В трех из этих пробирок постепенно, по мере добавления гидроксида натрия, появляется осадок. При этом, допустим в пробирке №1 осадок имеет зеленоватую окраску, которая при стоянии буреет. Следовательно, в этой пробирке находился железа (II).
|
|
|
FeCl2 + 2NaOH → Fe(OH)2  + 2NaCl
+ 2NaCl
Бело-зеленый
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3 
Коричневый
В пробирке №2 выпал белый осадок, который в избытке щелочи не растворяется. Следовательно, в пробирке №2 находился раствор хлорида кальция. СаCl2 + 2NaOH → Са(OH)2  + 2NaCl
+ 2NaCl
Белый
В пробирке №3 выпал белый осадок, который в избытке щелочи растворился. Следовательно, в пробирке №3 находился раствор хлорида алюминия. AlCl3 + 3NaOH → Al(OH)3  + 3NaCl
+ 3NaCl
Белый
Al(OH)3 + NaOH (изб.) → Na[Al(OH)4]
В пробирке № 4, где не выпал осадок, по методу исключения, находился хлорид аммония. Для проверки, содержимое пробирки слегка нагреваем . При этом появляется характерный запах аммиака, а мокрая лакмусовая индикаторная бумаг синеет от паров аммиака.
NH4Cl + NaOH→ NH4OH + NaCl
NH4OH  NH3 + H2O
NH3 + H2O
Доказано, что в пробирке №4 находился раствор хлорида аммония.
|
|
|
Задача5. Каким одним реактивом можно распознать кристаллические вещества сульфита натрия, сульфида натрия, нитрита натрия карбоната кальция и карбоната натрия, находящиеся в отдельных банках без этикеток? Приведите химизм процессов установления химического состава этих веществ.
Решение: Берем пронумерованные пробирки (№1-5), и из банок с соответствующими номерами, отсыпаем несколько кристаллов вещества. Все пробирки до половины заполняем водой и во все пробирки медленно добавляем концентрированный раствор серной кислоты.
Допустим, что в пробирке №1, где находилась водная суспензия нерастворимого в воде вещества. При добавлении серной кислоты наблюдается бурное выделение газа, осадок в начале растворяется и со временем, после прекращения выделения осадка, образуется белый, мелкодисперсный осадок. Эти наблюдения позволяют заключить, что в банке №1 находится карбонат кальция (мел или известняк).
СаСО3 + Н2SO4 → Са SO4 + [Н2СО3]*
[Н2СО3] → СО2  + Н2O
+ Н2O
* В химии квадратными скобками изображают химически неустойчивые при обычных условиях соединения.
Допустим, в пробирке № 2 наблюдается выделение бесцветного газа, не обладающим характерным запахом. Следовательно, в пробирке №2 находится карбонат натрия.
Na2СО3 + Н2SO4 → Na2SO4 + Н2O + СО2 
Допустим, в пробирке №3 наблюдается выделения газа с характерным едким запахом, который на воздухе буреет. Следовательно, в банке №3 находится нитрит натрия.
2NaNO2+ Н2SO4 → Na2SO4 + [НNO2]
[НNO2] → NO  + Н2O
+ Н2O
2NO + O2 → 2NO2 
бурый газ
Допустим, в пробирке № 4 выделяется газ, с характерным неприятным запахом тухлых яиц. При этом раствор мутнеет и со временем выпадает желтый порошок.
Наблюдение показывают, что в банке № 4 находится сульфид натрия.
Na2S + Н2SO4 → Na2SO4 + H2S 
запах тухлых яиц
3H2S+ Н2SO4→ 4Н2О + 4S 
желтый порошок
В последней пробирке наблюдаются выделение газа c резким запахом горелых спичек. Следовательно, в банке №5 находится сульфит натрия.
Na2SО3 + Н2SO4 → Na2SO4 + [H2SО3]
[H2SО3] → SO2  + Н2О
+ Н2О
Основные законы химии
Стехиометрические законы
Дата добавления: 2019-09-08; просмотров: 270; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
