Осмотическое давление определяют согласно закону Вант - Гоффа
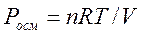 , (5.9)
, (5.9)
где n – количество вещества, моль;
R – газовая постоянная, равная 8,314 Дж/(моль·К);
Т – абсолютная температура, К;
V – объем раствора, м3.
Согласно закону Рауля, относительное понижение давления насыщенного пара над раствором равно мольной доле растворенного нелетучего вещества:
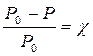 (5.10)
(5.10)
Повышение температуры кипения и понижение температуры замерзания растворов по сравнению с чистым растворителем, по следствию из закона Рауля прямо пропорциональны моляльной концентрации растворенного вещества:
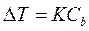 (5.11)
(5.11)
где 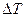 – изменение температуры,
– изменение температуры,
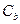 – моляльная концентрация (моль/кг),
– моляльная концентрация (моль/кг),
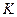 – коэффициент пропорциональности, в случае повышения температуры кипения называется эбулиоскопической константой, а для понижения температуры замерзания – криоскопической.
– коэффициент пропорциональности, в случае повышения температуры кипения называется эбулиоскопической константой, а для понижения температуры замерзания – криоскопической.
Эти константы, численно различные для одного и того же растворителя, характеризуют повышение температуры кипения и понижение температуры замерзания одномоляльного раствора, т.е. при растворении 1 моль нелетучего электролита в 1000 г растворителя. Поэтому их часто называют моляльным повышением температуры кипения и понижением температуры замерзания раствора. Криоскопические и эбулиоскопические константы не зависят от природы растворенного вещества, а лишь зависят от природы растворителя и характеризуются размерность 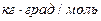 .
.
|
|
|
Таблица 5.1 – Некоторые физические характеристики промышленных растворителей
| Растворитель | Температура, 0С | Константа, | ||
| Кипения | Плавления | 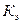
| 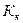
| |
| Н2О | 100 | 0 | 0,52 | 1,86 |
| С6Н6 | 80,1 | 5,5 | 2,53 | 5,12 |
| ССl4 | 76,5 | -22 | 5,03 | 30,0 |
| СНСl3 | 61,7 | -63,5 | 3,63 | 4,7 |
Криоскопия и эбулиоскопия – методы определения молекулярных масс растворенных веществ. Эти методы позволяют определить молекулярную массу не диссоциирующих при растворении веществ по понижению температуры замерзания и по повышению температуры кипения растворов известной концентрации:
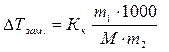 (5.12)
(5.12)
где 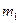 - масса растворенного вещества в граммах,
- масса растворенного вещества в граммах, 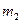 - масса растворителя в граммах,
- масса растворителя в граммах, 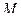 - молярная масса растворенного вещества в г/моль, 1000- коэффициент пересчета от граммов растворителя к килограммам. Из (1) молярная масса неэлектролита выразится как:
- молярная масса растворенного вещества в г/моль, 1000- коэффициент пересчета от граммов растворителя к килограммам. Из (1) молярная масса неэлектролита выразится как:
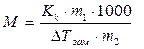 (5.13)
(5.13)
Растворимость S показывает, сколько граммов вещества может раствориться в 100 г воды при данной температуре. Растворимость твердых веществ с ростом температуры, как правило, возрастает, а для газообразных веществ - уменьшается.
|
|
|
Твердые вещества характеризуются самой различной растворимостью. Наряду с растворимыми веществами существуют малорастворимые и практически нерастворимые (в воде). Однако абсолютно нерастворимых веществ в природе нет. Рассмотрим равновесие между твердым осадком труднорастворимой соли AgCI и ее ионами в растворе:
AgCl(тв) = Ag+ + Clˉ
Константа равновесия имеет вид
Kр = ([Ag+]*[Clˉ]) / 1.
При этом концентрация конденсированной фазы [AgCl(тв)] как постоянная входит в величину Кр. Тогда константа равновесия определяется только произведением концентраций ионов [Ag+] и [Clˉ] в растворе и называется произведением растворимости:
ПР = [Ag+]*[Clˉ].
Для соединения АmBn
ПР = [А+]m * [Bˉ]n (5.14)
Величина ПР характеризует растворимость труднорастворимого электролита при постоянной температуре.
Следует различить понятия произведение растворимости(ПР) и произведение ионов (ПИ).
ПР, величина постоянная и показывает какое значение имеет произведение молярных концентраций ионов, образующиеся при диссоциации слабо растворимого вещества в насыщенном этим веществом растворе (водный раствор, содержащий осадок этого вещества).
|
|
|
ПИ это ионное произведение концентраций ионов в любом, искусственно созданном ( не насыщенном) растворе. Если значение ПИ > ПР, то образуется осадок мало растворимого вещества.
Пользуясь значениями ПР, можно рассчитать молярную концентрацию ионов в насыщенном растворе. Сопоставлением значений ПР и ПИ можно предсказать, выпадет ли осадок, при смешении двух растворов с определенными концентрациями и объемами?
Дата добавления: 2019-09-08; просмотров: 230; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!