Зависимость скорости реакции от температуры выражается правилом Вант-Гоффа:

 (4.5)
(4.5)
где 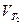 и
и 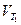 – скорости реакции при Т2 и Т1,
– скорости реакции при Т2 и Т1,
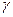 – температурный коэффициент, показывающий, во сколько раз увеличивается скорость реакции при повышении температуры на 10о.
– температурный коэффициент, показывающий, во сколько раз увеличивается скорость реакции при повышении температуры на 10о.
Одним из методов ускорения химической реакции является катализ, который осуществляется при помощи веществ (катализаторов), увеличивающих скорость реакции, но не расходующихся в результате ее протекания.
Механизм действия катализатора сводится к уменьшению величины энергии активации реакции, т.е. к уменьшению разности между средней энергией активных молекул (активного комплекса) и средней энергией молекул исходных веществ. Скорость химической реакции при этом увеличивается.
Понятие «химическое равновесие» применимо только к обратимым реакциям. Химическим равновесием называют такое состояние реагирующей системы, при котором скорость прямой реакции Vпрямая равна скорости обратной реакции Vобратная . Равенство скоростей прямой и обратной реакций является кинетическим условием химического равновесия.
Химическое равновесие характеризуется постоянным для данных условий соотношением равновесных концентраций всех веществ, участвующих во взаимодействии.
Величина, равная отношению произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ в степенях их стехиометрических коэффициентов, называется константой равновесия. Если в выражении константы равновесия концентрации веществ приведены в моль/л, то такая константа называется Кс. Когда реагирующие вещества находятся в газовой фазе, то можно концентрацию заменить на парциальные давления этих веществ. Константа равновесия, в которой концентрации реагирующих веществ представлены парциальными давлениями этих веществ называется Кр.
|
|
|
Для обратимой реакции
Н2(г) + I 2(г) 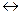 2 HI (г) (4.6)
2 HI (г) (4.6)
константа равновесия имеет вид:
Kc =  (4.7)
(4.7)
Для обратимой реакции синтеза аммиака N2+3H2  2NH3, константа равновесия имеет вид:
2NH3, константа равновесия имеет вид:
Kc =  (4.8)
(4.8)
Константа равновесия зависит от природы реагентов, температуры и не зависит от исходной концентрации веществ в системе.
Химическое равновесие остается неизменным до тех пор, пока постоянны параметры, при которых оно установилось. При изменении условий равновесие нарушается. Через некоторое время в системе вновь наступает равновесие, характеризующееся новым равенством скоростей и новыми равновесными концентрациями всех веществ.
|
|
|
Равновесие смещается в ту или иную сторону потому, что изменение условий по-разному влияет на скорости прямой и обратной реакций. Равновесие смещается в сторону той реакции, скорость которой при нарушении равновесия становится больше. Например, если при изменении внешних условий равновесие нарушается так, что скорость прямой реакции становится больше скорости обратной реакции, то равновесие смещается вправо.
В общем случае направление смещения равновесия определяется принципом Ле Шателье: если на систему, находящуюся в равновесии , оказывать внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет эффект внешнего воздействия.
Дата добавления: 2019-09-08; просмотров: 291; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
