Способы выражения состава растворов
Теоретические пояснения
Концентрация раствора – это относительное содержание растворенного вещества в растворе. Для выражения концентрации растворов существует два способа.
I . долевой способ:
1. массовая доля вещества ω, безразмерная величина или выражается в процентах, вычисляют по формуле
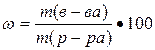 % (5.1)
% (5.1)
где m (в-ва) – масса вещества, г;
m (р-ра) – масса раствора, г.
2. мольная доля χ, величина безразмерная или выражается в процентах, вычисляют по формуле
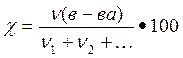 % (5.2)
% (5.2)
где ν(в-ва) – количество вещества, моль;
ν1+ν2+… – сумма количеств всех веществ в растворе, моль.
3. объемная доля φ, величина безразмерная или выражается в процентах, вычисляют по формуле
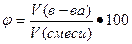 % (5.3)
% (5.3)
где V (в-ва) – объем вещества, л;
V (смеси) – объем смеси, л.
II . концентрационный способ:
1. молярная концентрация вещества CM, моль/л, вычисляют по формуле
 (5.4)
(5.4)
где n (в-ва) – количество вещества, моль;
V (р-ра) – объем раствора, л.
2. молярная концентрация эквивалента вещества (нормальная концентрация) СН, моль/л, вычисляют по формуле
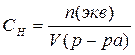 (5.5)
(5.5)
или
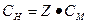 (5.6)
(5.6)
где n (экв) – количество вещества эквивалента, моль;
V (р-ра) – объем раствора, л;
Z – фактор эквивалентности.
3. моляльная концентрация вещества С b, моль/кг, вычисляют по формуле
|
|
|
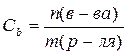 (5.7)
(5.7)
где n(в-ва) – количество вещества, моль;
m (р-ля) – масса растворителя, кг.
4. титр Т, г/мл, вычисляют по формуле
 (5.8)
(5.8)
где m (в-ва) – масса вещества, г;
V (р-ра) – объем раствора, мл.
Поскольку растворы это физико-химические системы необходимо рассмотреть процесс взаимодействия растворенного вещества с водой.
При образовании растворов характер взаимодействия компонентов определяется их химической природой, что затрудняет выявление общих закономерностей. Поэтому удобно прибегнуть к некоторой идеализированной модели раствора. Такой раствор, образование которого не связано с тепловым эффектом и с изменением объема называют идеальным раствором.
Хотя большинство растворов и не обладает в полной мере свойствами идеальных, однако свойства многих из них могут быть описаны при помощи этой модели. Наиболее подходящими в этом плане являются разбавленные растворы, в которых содержание растворенного вещества очень мало по сравнению с содержанием растворителя.
Рассмотрим свойства разбавленных растворов, которые зависят от числа частиц растворенного вещества и от количества растворителя, но практически не зависят от природы растворенных частиц (коллигативные свойства).
|
|
|
К таким свойствам относятся: понижение давления насыщенного пара растворителя над раствором, повышение температуры кипения, понижение температуры замерзания раствора по сравнению с чистым растворителем, осмотическое давление.
Осмос – это односторонняя диффузия веществ из растворов через полупроницаемую мембрану, разделяющую раствор и чистый растворитель или два раствора различной концентрации.
В системе растворитель-раствор молекулы растворителя могут перемещаться через перегородку в обоих направлениях. Но число молекул растворителя, переходящих в раствор в единицу времени, больше числа молекул, перемещающихся из раствора в растворитель.
Давление, которое надо приложить, чтобы скорости обоих процессов были равными, называют осмотическим.
Растворы, характеризующиеся одинаковым осмотическим давлением, называются изотоническими.
Дата добавления: 2019-09-08; просмотров: 263; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
