Примеры решения типовых задач
Задача 1 . Вычислите рН 0,01 М раствора HNO3.
Решение .
1. Через активность иона водорода (ан +). Метод целесообразно применять при расчете водородного показателя среды (рН) для кислот.
Активность иона водорода – функция концентрации иона водорода:
ан + = fн+  CH+ , (6.3)
CH+ , (6.3)
Коэффициенты активности ионов для растворов с различной ионной силой (I) приведены в приложении в таблице 15 учебника [3].
Ионную силу раствора считают по уравнению:
I = ½ 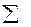 Ci*Zi 2, (6.4)
Ci*Zi 2, (6.4)
где Сi – концентрация ионов вещества i в растворе, моль/л.
Zi2 – заряд иона взятый по модулю в квадрате.
I = ½ (0,01  12 + 0,01
12 + 0,01  12)= 0,01,
12)= 0,01,
где CH += 0,01 моль/л; ZH +=1; 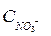 = 0,01 моль/л,
= 0,01 моль/л, 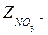 = 1.
= 1.
Из таблицы 15 учебника [3] находим, что при I = 0,01 функция fH+ равна 0,92.
Далее рассчитываем активность иона водорода:
ан + = 0,92  0,01 = 9,2
0,01 = 9,2  10-3 моль/л,
10-3 моль/л,
и по формуле (1) рН раствора:
рН = –lg 9,2  10-3 = 2,04.
10-3 = 2,04.
Ответ: рН (HNO3) = 2,04.
2. В случае расчета рН раствора щелочи целесообразно воспользоваться приведенной схемой для вычисления гидроксильного показателя среды рОН, а затем найти водородный показатель среды по формуле (5)
рН = 14 – рОН. (6.5)
3. При расчете водородного показателя среды водных растворов слабых кислот и оснований следует учитывать обратимость процесса их электролитической диссоциации ( 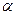 < 1):
< 1):
|
|
|
СНзСООН 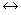 СНзСОО- + H+
СНзСОО- + H+
NH3  H2O
H2O 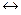 NH4+ + OH-
NH4+ + OH-
Н2СО3 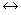 Н+ + НСО3-
Н+ + НСО3-
Концентрация ионов H+ в растворах слабых кислот и концентрация ионов ОН– в растворах слабых оснований численно равны концентрации продиссоциировавших молекул электролита, а не исходной концентрации раствора, как в случае сильных кислот и оснований.
Концентрацию продиссоциировавших на ионы молекул электролита (С) определяют, исходя из степени диссоциации:
С = α*Со , (6.6)
где Со – исходная концентрация молекул, моль/л,
α – степень диссоциации.
Степень диссоциации рассчитывают на основании закона разбавления Оствальда:
КД = 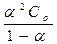 (6.7)
(6.7)
Значения КД, некоторых слабых электролитов приведены в справочных таблицах.
Примечание. Чаще пользуются формулой:
КД = 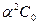 , (6.8)
, (6.8)
или
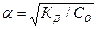 , (6.9)
, (6.9)
считая, что 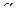 « 1. В случаях, когда расчет по упрощенному уравнению дает результат а > 0,1, вычисления повторяют, не пренебрегая величиной а в знаменателе дроби.
« 1. В случаях, когда расчет по упрощенному уравнению дает результат а > 0,1, вычисления повторяют, не пренебрегая величиной а в знаменателе дроби.
Определив степень диссоциации (α) и концентрацию молекул, распавшихся на ионы (С), вычисляют рН или рОН раствора электролита, считая, что С = СН+ , (кислота) или С = СОН- (основание).
|
|
|
При вычислении водородного или гидроксильного показателя среды раствора слабой кислоты или слабого основания можно считать, что 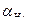 = СН+ и
= СН+ и 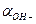 =СОН- в виду малых ионных сил растворов.
=СОН- в виду малых ионных сил растворов.
Задача 2. Вычислите рН 0,01 М раствора аммиака.
Решение. Поскольку раствор аммиака является слабой кислотой, то необходимо определить, сколько молекул NH3•Н2О распалось на ионы. Наиболее эффективно применять расчет через степень диссоциации.
1. Степень диссоциации NH3 • Н2О в 0,01 М растворе равна:
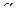 =
= 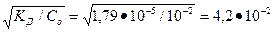 .
.
2. Находим концентрацию молекул NH3•Н2О, распавшихся на ионы, и равную ей концентрацию ионов ОН-:
С= а*Со = 4,2  10-2
10-2  10-2 = 4,2
10-2 = 4,2  10-4 моль/л, С=CОН- = 4,2
10-4 моль/л, С=CОН- = 4,2  10-4 моль/л.
10-4 моль/л.
Определяем рОН и рН 0,01 М раствора аммиака:
рОН = -lg СОН- = -lg 4,2  10-4 = 3,33, рН = 14 - 3,33 = 10,67.
10-4 = 3,33, рН = 14 - 3,33 = 10,67.
Ответ: рН (NH3•Н2О)=10,67
Задача 3. Вычислите ионную силу 0,01М раствора H2SO4. Найдите активность иона Н+(ан+) и рН этого раствора. Оцените, настолько отличаются значения 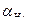 и СН+ ?
и СН+ ?
Решение: Вычислим ионную силу раствора, предположив, что при диссоциации одной моли серной кислоты в разбавленном растворе будет образоваться 2 моля протона и 1 моль аниона SO42- (исходя из уравнения диссоциации).
|
|
|
 H2SO4 2H+ + SO42-
H2SO4 2H+ + SO42-
I = ½ 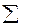 CiZi= ½ (0,02
CiZi= ½ (0,02  12 0,01
12 0,01  22) = 0,03
22) = 0,03
Из справочных данных для такого значения ионной силы находим:
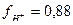 и, следовательно СН+= 0,88
и, следовательно СН+= 0,88  0,02 = 0,0176моль/л, и рН=1,75.
0,02 = 0,0176моль/л, и рН=1,75.
Если пренебречь значением коэффициента активности и считать, сто концентрация протона СН+= 0,02моль/л, тогда рН = - lg 0,02 = 1,7.
Таким образом, мы показали, что приравнивание активности протона к его молярной концентрации в разбавленных растворах кислот приводит к искажению значения рН на 0,05 единиц, что составляет 3% от величины рН.
Ответ: рН (H2SO4) = 1,75.
Задача 4. Смешали 100 мл 0,5м раствора соляной кислоты и 150 мл 0,5 М раствора гидроксида натрия. Вычислить рН образовавшегося раствора.
Решение: При смешении кислоты со щелочью происходит химическая реакция нейтрализации: HCl + NaOH 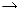 NaCl +H2O
NaCl +H2O
Вычислим количества веществ кислоты и щелочи в исходных растворах.
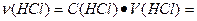 0,5
0,5  0,1=0,05моль;
0,1=0,05моль;
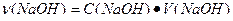 = 0,5
= 0,5  0,15=0,075 моль.
0,15=0,075 моль.
Следовательно, в смешанном растворе, после полной нейтрализации останется не нейтрализованные молекулы гидроксида натрия. Определим молярную концентрацию щелочи в образовавшемся растворе. Количества вещества избытка щелочи 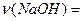 0,075 – 0,05 = 0,025 моль. Объем раствор V(р-ра) = 0,1+ 0,15 = 0,25л. Концентрация щелочи
0,075 – 0,05 = 0,025 моль. Объем раствор V(р-ра) = 0,1+ 0,15 = 0,25л. Концентрация щелочи 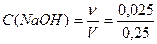 =0,1моль/л.
=0,1моль/л.
|
|
|
рОН = –lg0,1 = 1;
рН = 14 – рОН = 14 – 1=13.
Ответ: рН = 13.
Задача 5. Константа диссоциации синильной кислоты HCN составляет 6,2•10-10 (рКа = 9,21). Найдите: а) степень диссоциации; б) концентрацию ионов Н+ ; в) рН раствора, если концентрация раствора кислоты 0,1 моль/л.
Решение: Математическая связь между степенью диссоциации 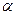 и константой диссоциации выражена в уравнение Оствальда, которое иногда называют законом разбавления:
и константой диссоциации выражена в уравнение Оствальда, которое иногда называют законом разбавления:
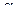 =
= 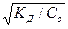
Как видно, при уменьшении концентрации электролита Со, дробь возрастает, что приводит к увеличению значения 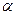 . Таким образом, экспериментально установлено, степень диссоциации электролита в растворе зависит от его концентрации, или иначе говоря, при разбавлении растворов степень диссоциации растворенного электролита растет. Этот закон записывают следующим образом:
. Таким образом, экспериментально установлено, степень диссоциации электролита в растворе зависит от его концентрации, или иначе говоря, при разбавлении растворов степень диссоциации растворенного электролита растет. Этот закон записывают следующим образом: 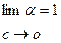 .
.
1) Вычислим степень диссоциации 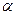 =
= 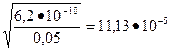
2) Вычислим концентрацию протона: Н+ = 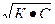 . Так как нам известно, что значение рКа = - lgK = 9,21, то удобнее преобразовать это уравнение так:
. Так как нам известно, что значение рКа = - lgK = 9,21, то удобнее преобразовать это уравнение так:
pH= -lgH+= - 0,5lgK - 0,5lgC = 0,5pK - 0,5lg0,1= 0,5  9,21 + 0,5 = 4,605+0,5=5,105.
9,21 + 0,5 = 4,605+0,5=5,105.
Ответ: рН = 5,105.
Буферные растворы
Теоретические пояснения
Буферным называют раствор, рН которого не изменяется при его разбавлении или добавлении небольших объемов сильной кислоты или сильного основания.
Буферный раствор состоит из слабой кислоты и ее соли (СН3СООН-СН3ССОNa) или слабого основания и его соли (NH4OH - NH4Cl). Из слабых многоосновных кислот и их солей также можно приготовить буферные растворы, например Н3РО4 – NaH2PO4 и NaH2РО4 – Na2HPO4 .
Значения рН буферного раствора, состоящего из кислоты и его соли, рассчитывают по уравнению
рН= рКНА - lg 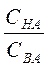 , (7.1)
, (7.1)
где СНА и СВА – молярные концентрации кислоты и соли в буферном
растворе, моль/л;
КНА – константа диссоциации кислоты, моль/л.
Из уравнения 1 следует, что значения рН буферных растворов зависиттолько от отношения общих концентраций компонентов раствора и не зависит от разбавления (в определенных пределах). При изменении объема раствора концентрация каждого компонента изменяется в одинаковое число раз, а отношение концентраций не меняется.
При условии СНА= СВА отношение 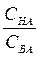 =1 и lg
=1 и lg 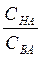 =о. То есть, рН= рКНА
=о. То есть, рН= рКНА
Для буферных растворов, состоящих из слабого основания ВОН и его соли ВА, значение рН рассчитывают по формуле
рН=14 – рКВОН + lg 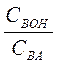 . (7.2)
. (7.2)
Величину буферного действия характеризуют с помощью буферной емкости, равной числу молярных масс эквивалента сильной кислоты или сильного основания, которое можно добавить к 1 литру буферного раствора, чтобы рН изменился на единицу.
Буферная емкость зависит от природы и общих концентраций компонентов буферного раствора, а также от соотношения их концентраций. Чем больше концентрация компонентов буферного раствора и чем ближе к единице отношение 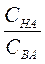 (в случае кислых буферов) и
(в случае кислых буферов) и 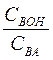 (в случае основных буферов), тем больше буферная емкость.
(в случае основных буферов), тем больше буферная емкость.
Буферная емкость максимальна, когда вышеприведенные отношения равны единице. Если Б – буферная емкость, а и b – число молярных масс эквивалентов соответственно кислоты (НCl) и основания (NaOH), то
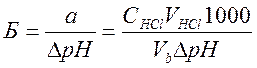 (7.3)
(7.3)
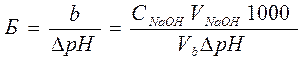 (7.4)
(7.4)
где 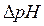 - изменение рН при добавлении данного количества кислоты или основания к объему (Vb) буферного раствора.
- изменение рН при добавлении данного количества кислоты или основания к объему (Vb) буферного раствора.
Дата добавления: 2019-09-08; просмотров: 231; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
