Примеры решения типовых задач
Задача 1. Реакция между веществами А и В протекает по уравнению 2A + B = C; концентрация вещества А равна 6 моль/л, а вещества В - 5 моль/л. Константа скорости реакции равна 0,5 л2моль-2•с –1. Вычислите скорость химической реакции в начальный момент и в тот момент, когда в реакционной смеси останется 45 % вещества В.
Решение . Согласно закону действующих масс скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам. Следовательно, для уравнения реакции в нашем примере V = K * CA 2 * CB
Скорость химической реакции в начальный момент равна:
V=0,5. 62 . 5 = 90,0 моль. с-1 . л-1
По истечении некоторого времени в реакционной смеси останется 45 % вещества В, т. е. концентрация вещества В станет равной 5. 0,45= 2,25 моль/л. Значит, концентрация вещества В уменьшилась на 5,0 - 2,25= 2,75 моль/л. Так как вещества А и В взаимодействуют между собой в соотношении 2 : 1, то концентрация вещества А уменьшилась нa 5,5 моль/л (2,75 . 2) и стала равной 0,5 моль/л (6,0 - 5,5). Следовательно, V2 = 0,5(0.5)2 • 2,25 = 0,28 моль. с-1 . л-1.
Ответ: 0,28 моль. с-1 . л-1
Задача 2.Как изменится скорость прямой реакции 2СО + О2 = 2СО2
если общее давление в системе увеличить в 4 раза?
Решение. Увеличение давления в системе в 4 раза вызовет уменьшение объема системы в 4 раза, а концентрация реагирующих веществ возрастет в 4 раза. Это вытекает из газовых законов, в соответствии с которыми, давление прямо пропорционально концентрации газа в объеме.
|
|
|
PV=  . Так как молярная концентрация вещества См (моль/л) определяется как отношение количества вещества (моль) к объему, то Р =
. Так как молярная концентрация вещества См (моль/л) определяется как отношение количества вещества (моль) к объему, то Р =  .
.
Согласно закону действующих масс начальная скорость реакции равна V1 =  .
.
После увеличения давления в 4 раза, концентрация каждой компоненты вырастит в 4 раза. Тогда V2= k  = 43
= 43  = 64
= 64  = 64V1
= 64V1
Следовательно, после увеличения давления в 4 раза скорость реакции возросла в 64 раза.
Ответ: скорость реакции возросла в 64 раза.
Задача 3. Константа скорости реакции А + 2В 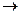 3С равна 0,6 л2 моль-2 с-1. Исходные концентрации веществ А и В составляли по 0,75моль/л. В результате реакции концентрация вещества В оказалось равной 0,5 моль/л. Вычислите, какова концентрация веществ А и С, начальную скорость и скорость прямой реакции, когда концентрация вещества В стала 0,5 моль/л.
3С равна 0,6 л2 моль-2 с-1. Исходные концентрации веществ А и В составляли по 0,75моль/л. В результате реакции концентрация вещества В оказалось равной 0,5 моль/л. Вычислите, какова концентрация веществ А и С, начальную скорость и скорость прямой реакции, когда концентрация вещества В стала 0,5 моль/л.
Решение. Начальную скорость реакции считаем, пользуясь законом действующих масс:
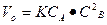 = 0,6
= 0,6  0,75
0,75  (0,75)2= 0,6
(0,75)2= 0,6  (0,75)3= 0,253 моль
(0,75)3= 0,253 моль  л-1
л-1  с-1.
с-1.
Допустим, имеем один литр реакционной смеси. Следовательно, в реакционной смеси имеем по 0,75 моль исходных реагентов. Когда концентрация вещества В стала 0,5 моль/л, значит в реакцию вступило 0,75 - 0,5 = 0,25 моль вещества В. Так как вещества А и В реагируют в мольных отношениях 1 : 2, то изменение концентрации вещества А при этом составит 0,5  0,25= 0,125 моль. Следовательно, в системе останется 0,75 – 0,125 = 0,625 моль вещества А.
0,25= 0,125 моль. Следовательно, в системе останется 0,75 – 0,125 = 0,625 моль вещества А.
|
|
|
Рассчитаем скорость реакции. V1= 0,6  0,625
0,625  (0,5)2= 0,09375 моль
(0,5)2= 0,09375 моль  л-1
л-1  с-1.
с-1.
Вещество С образуется в мольном отношении к веществу А равному 3:1, следовательно при расходе вещества А 0,125 буде образоваться 3  0,125= 0,375 моль вещества С. Так как в начале реакции в реакционной системе отсутствовало вещество С, то его концентрация будет 0,375 моль/л.
0,125= 0,375 моль вещества С. Так как в начале реакции в реакционной системе отсутствовало вещество С, то его концентрация будет 0,375 моль/л.
При сопоставлении значений скорости реакции в начальный момент и после превращения, то окажется, что скорость реакции по ходу уменьшилась в 0,253:0,09375= 2,7 раза. Такая закономерность обусловлена тем, что во времени происходит расходование исходных веществ. А по закону действующих масс, скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам.
Ответ: скорость реакции уменьшилась в 2,7 раза.
Задача 4: На сколько градусов нужно повысить температуру, чтобы скорость реакции возросла в 90 раз? Температурный коэффициент равен 2,7.
Решение: В соответствии с правилом Вант – Гоффа.
|
|
|

 ;
;  ;
; 
Ответ: Для того, чтобы скорость реакции возросла в 90 раза, необходимо повышать температуру реакционной смеси на 45,450С.
Задача 5: При 100С реакция заканчивается за 95с, а при 200С за 60с. Вычислить энергию активации этой реакции.
Решение: Чем дольше протекает реакция, тем она медленнее и наоборот. Поэтому, время реакции,  . Скорость реакции при 100С обозначим через V1, а при 200С - V2. Тогда
. Скорость реакции при 100С обозначим через V1, а при 200С - V2. Тогда  .
.
Взаимосвязь константы скорости реакции с энергией активации определяется уравнением Аррениуса:
К=  или, как иногда упрощенно пишут К=Аехр(-
или, как иногда упрощенно пишут К=Аехр(- 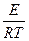 ),
),
где А - предэкспоненциальный множитель, зависит от типа реакции, Е- энергия активации (кДж/моль), также зависит от типа реакции и не зависит от температуры. Таким образом, константа скорости реакции зависит от типа реакции (А и Е) и от температуры (T).

 . С другой стороны
. С другой стороны  = 1,58.
= 1,58.
ln1,58= 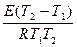 ; E=
; E= 
Ответ: 31,49 кДж/моль.
Задача 6: Через некоторое время после начала реакции 3А + В  2С +D концентрация веществ А, В и С составляли (моль/л) 0,03; 0,01; 0,008 соответственно. Каковы исходные концентрации веществ А и В?
2С +D концентрация веществ А, В и С составляли (моль/л) 0,03; 0,01; 0,008 соответственно. Каковы исходные концентрации веществ А и В?
Решение: Допустим, что имеем один литр реакционной смеси, в которой в начале реакции отсутствовали вещества С и D. Так как за время реакции образовалось 0,008 моль вещества С, то за это время прореагировало два раза меньше вещества В (в соответствии с уравнением реакции). Таким образом, исходная концентрация вещества В составляла 0,01 + 0,004= 0,014моль/л. Если прореагировало 0,004 моль вещества В, то по уравнению реакции в это же время прореагировало 3 раза больше вещества А, то тесть 0,004  3=0,012 моль. Так как осталось 0,03 моль вещества А, то его начальная концентрация составляла 0,03+ 0,012= 0,042 моль/л.
3=0,012 моль. Так как осталось 0,03 моль вещества А, то его начальная концентрация составляла 0,03+ 0,012= 0,042 моль/л.
|
|
|
Ответ: С0(А) = 0,042 моль/л; С0(В) =0,014моль/л.
Задача 7: Рассчитать константу скорости реакции первого порядка, учитывая, что за 25 мин реакция проходит на 25%.
Решение: Дифференциальное уравнение для реакций первого порядка, а именно реакции, протекающие по схеме: А  В, имеет вид:
В, имеет вид:
-  . Знак минус показывает, что рассматриваем процесс уменьшения концентрации вещества А во времени. Преобразуем это дифференциальное уравнение и проинтегрируем в неопределенных условиях:
. Знак минус показывает, что рассматриваем процесс уменьшения концентрации вещества А во времени. Преобразуем это дифференциальное уравнение и проинтегрируем в неопределенных условиях:
 , -lnCA= Kt + соnst. При t=0, соnst =- lnCoA и
, -lnCA= Kt + соnst. При t=0, соnst =- lnCoA и 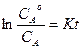 .
.
Отсюда
 ,
,  .
.
Ответ: K1 = 1,15 * 10-3 сек-1
Задача 8. При синтезе аммиака N2 +3H2  2NH3 равновесие установилось при следующих концентрациях реагирующих веществ (моль/л):
2NH3 равновесие установилось при следующих концентрациях реагирующих веществ (моль/л):
 = 2,5;
= 2,5;  = 1,8;
= 1,8;  = 3,6. Рассчитайте константу равновесии этой реакции и исходные концентрации азота и водорода,
= 3,6. Рассчитайте константу равновесии этой реакции и исходные концентрации азота и водорода,
Решение. Определяем константу равновесия КС этой реакции:
Kc =  = (3,6)2/ 2,5 (1,8)3 = 0,89
= (3,6)2/ 2,5 (1,8)3 = 0,89
Исходные концентрации азота и водорода находим на основе уравнения реакции. На образование 2 моль NH3,, расходуется 1 моль азота, а на образование 3,6 моль аммиака потребовалось З,6/2 = 1,8 моль азота. Учитывая равновесную концентрацию азота, находим его первоначальную концентрацию:
Сисх (Н2) = 2,5 + 1,8 = 4,3 моль/л
На образование 2 моль NH3 необходимо израсходовать 3 моль водорода, и для получения 3,6 моль аммиака требуется 3х3,6/2=5,4 моль; Сисх(Н2) = 1,8 + 5,4 = 7,2 моль/л.
Таким образом, реакция начиналась при концентрациях (моль/л): С(N2) = 4.3 моль/л; C (H2) = 7,2 моль/л
Ответ: С(N2) = 4.3 моль/л; C (H2) = 7,2 моль/л
Задача 9. Объемный состав реакционной смеси в момент равновесия для реакции 2СО2 = 2СО+О2 был следующий: 88,72 % СО2; 7,52 % СО; 3,76 % О2. Найдите Кр для реакции, если общее давление в системе при данной температуре (2273 К) равно 1,0133 • 105 Па,
Решение. Для реакций, протекающих между газами, при вычислении константы равновесия удобно пользоваться парциальным давлениями реагирующих веществ. Константу равновесия Кр - вычисляют через парциальные давления:
Кр = 
Определив парциальные давления реагирующих веществ:
 = 1,0133
= 1,0133  105
105  0,8872= 0,8990 * 105 Па;
0,8872= 0,8990 * 105 Па;
РСО =1, 0133 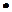 105•0,0752 =0,0762 * 106 Па;
105•0,0752 =0,0762 * 106 Па;
 = 1,0133
= 1,0133  105
105 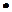 0,0376= 0,0381 * 105 Па,
0,0376= 0,0381 * 105 Па,
Подставив соответствующие значения парциальных давлений СО2, СО и О2 в выражение 1 получим Кр = 27,35 Па.
Ответ: Кр = 27,35 Па
Задача 10. Реакция протекает по уравнению А+В 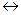 2С. Определите равновесные концентрации реагирующих веществ, если исходные концентрации веществ А и В соответственно равны 0,5 и 0,7 моль/л, а константа равновесия реакции КС =50.
2С. Определите равновесные концентрации реагирующих веществ, если исходные концентрации веществ А и В соответственно равны 0,5 и 0,7 моль/л, а константа равновесия реакции КС =50.
Решение. К моменту равновесия концентрации веществ А и В понизятся, а концентрация вещества С увеличится. На каждый моль веществ А и В образуется 2 моль вещества С; поэтому, если понижение концентрации веществ А и В обозначить через Х моль, то увеличение концентрации вещества С будет равно 2Х моль.
Равновесные концентрации реагирующих веществ будут: СА= (0,5- х) моль/л; СВ = (0,7-х)моль/л; СС = 2х моль/л.
Кс = С2 С /САСВ = 4х2/(0,5 –х) ( 0,7-х) =4х2 / (0,35 – 1,2х + х2) = 50;.
Решая это уравнение, получаем: х1 = 0,86; х2 = 0,44. Так как, исходные концентрации веществ А и В были 0,5 и 0,7 моль/л соответственно, то их конверсия (превращение или расход) не может быть выше этих величин. Следовательно, по условию задачи справедливо значение х2. Отсюда равновесные концентрации реагирующих веществ равны: СА=0,5 - 0,44 = 0,06 моль/л; СВ = 0,7- 0,44 = 0,26 моль/л; СС = 0,44  2 = 0,88 моль/л.
2 = 0,88 моль/л.
Ответ: СА= 0,06 моль/л; СВ = 0,26 моль/л; СС =0,88 моль/л.
Задача 11: Рассчитайте константу равновесия реакции
С25Н2807 + НС1  С25Н27О6С1 + Н2O
С25Н27О6С1 + Н2O
если для ее проведения смешали 12 мл 10-2М раствора С25Н2807 и 15 мл 10-2М раствора НС1. Полученную смесь разбавили водой до 50 мл. Равновесная концентрация С25Н27О6С1 оказалась равной 2,03  10-3 моль/л.
10-3 моль/л.
Решение: Вычислим количество исходных и конечных веществ до и после реакции. Известно, что количество вещества определяется как произведение молярной концентрации (моль/л) и объема раствора (в литрах). Тогда имеем:
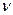 о(С25Н2807)=12
о(С25Н2807)=12 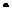 10-3
10-3  10-2=1,2
10-2=1,2 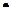 10-4моль, и
10-4моль, и  о (НСl)=15
о (НСl)=15 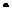 10-3
10-3  10-2=1,5
10-2=1,5  10-4 моль.
10-4 моль.
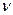 (С25Н27О6С1) = 50
(С25Н27О6С1) = 50  10-3
10-3  2,03
2,03  10-3=1,015
10-3=1,015  10-4 моль.
10-4 моль.
Если образовалось продукт, в количестве 1,015  10-4 моль, то в соответствии с реакцией, столько же было израсходовано соляной кислоты и С25Н2807. Следовательно, в равновесной смеси, концентрация исходных веществ составит: СМ(С25Н2807)=
10-4 моль, то в соответствии с реакцией, столько же было израсходовано соляной кислоты и С25Н2807. Следовательно, в равновесной смеси, концентрация исходных веществ составит: СМ(С25Н2807)=  и СМ(НСl)=
и СМ(НСl)=  . Константу равновесия считаем по уравнению КС =
. Константу равновесия считаем по уравнению КС =  =
= 
Ответ: 5,66 * 103
Задача 12: Константа химического равновесия реакции С2H6(г)  С2Н4(г)+ Н2(г) при 1500К равна 38,4. Определить направление реакции, если в начале реакции парциальные давления в газовой смеси компонентов составляли: этана - 0,06Мпа, этилена - 0,02 Мпа и водорода 0,01 МПа.
С2Н4(г)+ Н2(г) при 1500К равна 38,4. Определить направление реакции, если в начале реакции парциальные давления в газовой смеси компонентов составляли: этана - 0,06Мпа, этилена - 0,02 Мпа и водорода 0,01 МПа.
Решение: В этой задаче приведены парциальные давления реагирующих компонентов смеси. Поэтому, в данном случае следует пользоваться выражение Кр.
Кр= 
Как видно, расчет значения Кр по исходным показателям давления реагирующих газов дает значения, намного меньше, чем значения константы равновесия (38,4). Это означает, что в результате химических превращений, давления реагирующих газов изменились таким образом, что их отношение приводит к увеличению дроби. Такая ситуация возможна, если возраст числитель, при этом уменьшится знаменатель. То есть, в реакционной среде должно быть увеличено давление этилена и водорода, и уменьшено давление этана. Такая ситуация возможна, если в ходе реакции будет израсходован этан (знаменатель) в результате чего будут возрастать давление водорода и этилена. Это означает, что реакции направлена слева на право, то есть реакция идет в сторону разложения этана с образованием водорода и этилена.
Ответ: равновесие сдвинуто вправо.
Дата добавления: 2019-09-08; просмотров: 2368; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
