Нарушение общего кровообращения при перикардите и тампонаде сердца. Этиология и патогенез перикардитов и тампонады сердца. Механизмы компенсации, рефлекторные влияния с перикарда.
Перикардит – воспаление перикарда с отложением фибрина и/или экссудацией в полость перикарда. Три формы: сухой, выпотный (экссудативный , в т.ч с тампонадой сердца) и констриктивный. Этиология: инфекция, грибковое, проявление системного заб-ния, проявление постинфарктного синдрома. Куссмауль, немецкий терапевт открыл ключевые симптомы нарушения опорожнения правого желудочка при тампонаде сердца и констриктивном перикардите – парадоксальное увеличение давления в яремных венах на вдохе и парадоксальный пульс – подчеркнуто выраженное снижение систолического артериального кровяного давления на вдохе (признаки Куссмауля, 1873 г.)
Тетрада Бека при констриктивном перикардите и тампонаде:
l Гипотензия
l Высокое югулярное давление
l Глухие тоны
l Понижение системного артериального давления на вдохе, парадоксальный пульс
Синдром карликовости Mulibrey: Аутосомно-рецессивный синдром, характеризующийся задержкой роста, мышечной гипотонией, гепатомегалией, изменениями глаз, увеличеним желудочков мозга, задержкой умственного развития и хроническим констриктивным перикардитом.
Тампонада сердца – сдавление сердца в рез-те быстрого накопления большого количества жидкости в перикардиальной сумке и повышения в ней давления. При этом затрудняется заполнение кровью камер сердца в период диастолы. Повышение интраперикардиального давления приводит в последующем к повышению ЦВД; одновременно снижается СВ. Этиология: вирусный или идиопатический острый перикардит, травмы, радиационное, разрыв сердца,застойная СН, гипоальбуминемия. Важнейший признак сердечной тампонады уменьшение систолического АД при вдохе, чем в норме (10 мм рт. ст.). Его можно выявить, пальпируя ослабление или исчезновение артериального пульса во время вдоха. Парадоксальный пульс не патогномоничен для заболевания перикарда, поскольку он может встречаться при различных формах рестриктивных кардиомиопатий и при обструктивном, либо гиповолемическом шоке и тяжелой бронхиальной астме.
|
|
|
Включение компенсаторных механизмов при перикардите происходит рефлекторно с участием сигналов, поступающих из трех рецепторных полей:
1) отверстий полых и легочных вен — повышенным давлением на путях притока;
2) аорты и сонных синусов (синокаротидные зоны) — снижением давления на путях оттока и последующим уменьшением депрессорного эффекта;
3) перикарда, раздражаемого повышенным интраперикардиальным давлением. При перерезке блуждающих и депрессорных нервов, а также при выключении рецепторных полей с помощью новокаина приспособительные механизмы не включаются и нарушения кровообращения протекают намного тяжелее. При тампонаде сердца мобилизация мощных механизмов компенсации, которые ведут к усилению сокращений сердца (гомео- и гетерометрические механизмы, инотропный эффект катехоламинов), малоэффективна и невозможна. Поэтому работает только сравнительно маломощный и энергетически расточительный механизм компенсации и поддержания артериального давления — учащение сокращений сердца, к которому затем подключается сужение периферических сосудов.
|
|
|
При более медленном накоплении жидкости в перикарде работа компенсаторных механизмов оказывается более эффективной; повышение внутриперикардиального давления в течение некоторого времени может компенсироваться.
159. Пороки сердца. Виды, этиология, патогенез. Особенности этиологии и патогенеза врожденных пороков сердца. Недостаточность двухстворчатого клапана (стадии компенсации и декомпенсации), показатели кровообращения.
Пороки сердца — патологическое состояние сердца, в ходе которого наблюдаются дефекты клапанного аппарата или его стенок, приводящие к нарушениям внутрисердечной и системной гемодинамики, сердечной недостаточности. Различают две большие группы пороков сердца: врождённые и приобретённые.
|
|
|
Этиология
Среди причин выделяют:
1) воспалительные (ревматическая болезнь сердца, системная красная волчанка, системная склеродермия);
2) дегенеративные (миксоматозная дегенерация, синдром Марфана, Элерса–Данло, кальциноз митрального кольца);
3) инфекционные (инфекционный эндокардит);
4) структурные (разрыв сухожильных хорд, надрыв или дисфункция папиллярных мышц, дилатациямитрального кольца, гипертрофическая кардиомиопатия, недостаточность протеза клапана);
5) врожденные (расщепление, фенестрация митральных створок, парашютовидная деформация клапана)
Классификация
1. По локализации клапанного поражения
• Пороки митрального клапана
• Пороки аортального клапана
• Пороки трехстворчатого клапана
• Пороки клапана легочной артерии
• Сложные пороки (наличие пороков сразу нескольких клапанов)
2. По характеру поражения клапана
• Стеноз (сужение отверстия клапана)
• Недостаточность (неполное смыкание створок клапана)
• Комбинированные (= сочетанные) (сочетание на одном клапане стеноза и недостаточности)
Митральная недостаточность (регургитация) – состояние, сопровождающееся перегрузкой объемом левого предсердия и левого желудочка. Обычно заболевание протекает бессимптомно многие годы, но, в конце концов, приводит к сердечной недостаточности.
|
|
|
Митральная регургитация (МР) – второй по частоте клапанный порок сердца (после аортального стеноза), частота в развитых странах составляет 5 случаев на 10000.
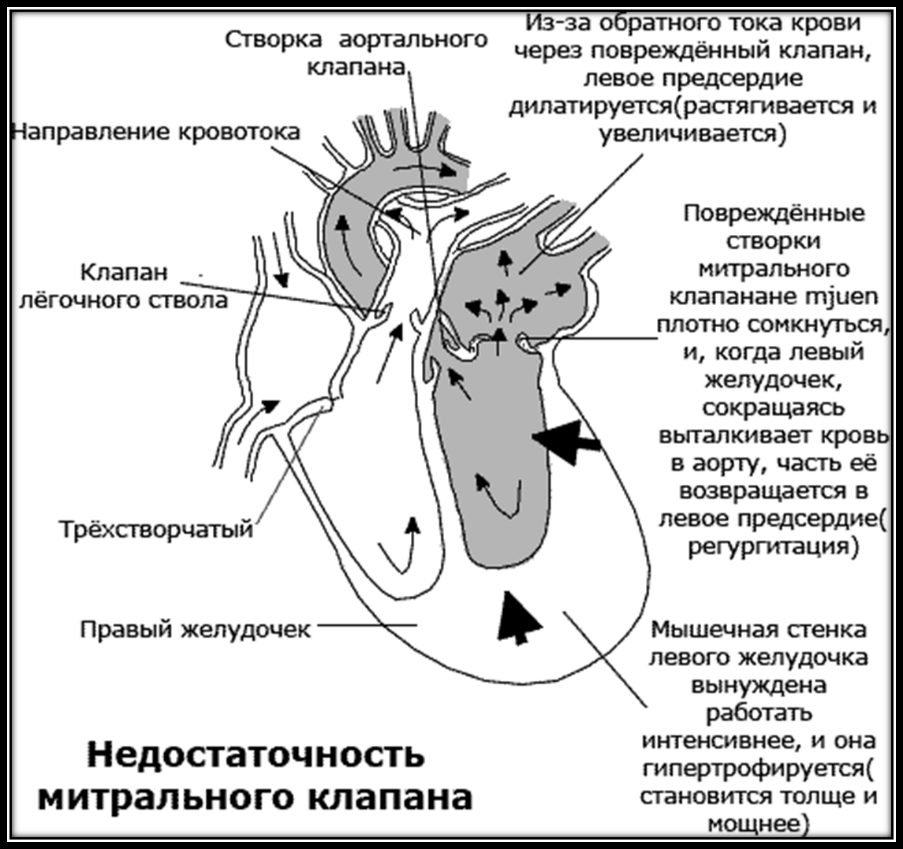
Классификация
а) по течению (острая и хроническая);
б) в зависимости от этиологии (неишемическая и ишемическая);
в) по степени тяжести
В клиническом течении митральной недостаточности выделяют 3 стадии:
I (компенсированная стадия) - незначительная недостаточность митрального клапана; митральная регургитация составляет 20-25% от систолического объема крови. Митральная недостаточность компенсируется за счет гиперфункции левых отделов сердца.
II (субкомпенсированная стадия) - митральная регургитация составляет 25-50% от систолического объема крови. Развивается застой крови в легких и медленное нарастание бивентрикулярной перегрузки.
III (декомпенсированная стадия) - резко выраженная недостаточность митрального клапана. Возврат крови в левое предсердие в систолу составляет 50-90% от систолического объема. Развивается тотальная сердечная недостаточность.
160. Общие механизмы компенсации при приобретенных пороках сердца. Стеноз левого атрио-вентрикулярного отверстия (стадии компенсации и декомпенсации), показатели кровообращения. Феномен "второго барьера", его роль в патогенезе стеноза левого атрио-вентрикулярного отверстия.
Приобретённые пороки сердца - нарушение деятельности сердца, обусловленное морфологическими или функциональными изменениями одного или нескольких его клапанов.
Причинами приобретенных пороков могут быть ревматизм (в большинстве случаев), атеросклероз, сифилис, бактериальные и вирусные эндокардиты, травма.
Общие механизмы компенсации при приобретенных пороках сердца
1)При недостаточности клапанов - усиление систолы и опорожнение полостей сердца без предшествующего увеличения диастолического объема. Изотонические (длина уменьшается, напряжение не меняется) более энергетически выгодно. Сущность гиперфункции состоит в том, что соответствующий желудочек во время систолы выбрасывает больше крови, чем в норме. Увеличивается УО и объем возвращающейся крови. При этом отсутствует повышение внутрижелудочкового давления и этапа напряженного миокарда, так как разрушенные клапаны не позволяют обеспечить герметизацию полостей сердца.
2)При стенозах - усиление систолы при увеличении диастолического объема вследствие повышения степени растяжения волокон миокарда во время диастолы. изометрическое (длина не меняется, напряжение увеличивается) - при стенозе клапанов. Сущность гиперфункции заключается в том, что из соответствующей полости сердца во время систолы через суженное отверстие выбрасывается нормальное количество крови за счет увеличения внутрижелудочкового или внутрипредсердного давления.
Напряжение, развиваемое сердцем во время систолы, пропорционально концентрации кальция в миоплазме и количеству доступных тропониновых молекул, фиксированных в регуляторных субъединицах.
На основе этих представлений можно объяснить основные механизмы, мобилизующие функцию сердечной мышцы:
1. Закон Старлинга - (отношение «длина-сила») чем больше желудочки растягиваются кровью во время диастолы, тем сильнее их сокращение в следующую систолу.
2. Закон Хилла - (отношение «скорость сокращения-сила») способность сердца выбрасывать при увеличении сопротивления прежний объем крови за счет усиления сократительной функции .
3. Закон (лестница) Боудича - (отношение «интервал-сила») По мере увеличения частоты сердечных сокращений до определенного предела возрастают сила и скорость развития каждого сокращения .
4. Механизм увеличения скорости диастолического расслабления.
5. Инотропные влияния, реализующиеся через катехоламины. Увеличивают поступление Са, ускоряют его захват, активируют АЦ.
Стеноз левого атриовентрикулярного отверстия - это сужение левого атриовентрикулярного отверстия, которое приводит к затруднению опорожнения левого предсердия (ЛП) и увеличению градиента диастолического давления между ЛП и ЛЖ.
В норме площадь левого атриовентрикулярного отверстия 4 - 6 кв. см. При сужении до 2 кв. см,("первый барьер") Компенсация происходит за счет повышения давления в ЛП. Полость ЛП растягивается сильнее, в ней остается часть крови, которая должна была поступить в желудочек, предсердия сокращаются с большей силой, гипертрофируются. Далее увеличивающееся сопротивление оттоку крови вызывает еще большее растяжение полости левого предсердия, сокращения предсердия становятся малоэффективными. Возникает мерцание предсердий, которое приводит к еще большему застою крови.
Вторым гемодинамическим следствием митрального стеноза является застой крови в малом круге кровообращения и повышение давления в легочной артерии. Различают два варианта легочной гипертензии:
- “Венозная” (“пассивная”) легочная гипертензия. Умеренное повышение давления в ЛП (ниже 25–30 мм рт. ст.) затрудняет венозный кровоток в малом круге кровообращения. В результате происходит переполнение венозного русла кровью — застой крови в легких.
- “Артериальная” (“активная”) легочная гипертензия. Чрезмерное повышение давления в ЛП (более 25–30 мм рт. ст.), при более выраженном стенозе. Возникает защитный рефлекторный спазм легочных артериол в результате которого уменьшается приток крови к легочным капиллярам из ПЖ, но одновременно резко возрастает давление в легочной артерии.
Существование легочной гипертензии сопровождается разитием органических пролиферативных и склеротических процессов в стенке артериол малого круга кровообращения, которые постепенно облитерируются. Эти необратимые изменения сосудов малого круга поддерживают стойкое повышение давления в легочной артерии. На пути кровотока появляется “второй барьер”.
В свою очередь, повышение давления в системе легочной артерии приводит к расширению ее клапанного кольца. Возникает недостаточность клапанов легочной артерии, в результате чего часть крови начинает забрасываться обратно в правый желудочек, его полость дилятируется, он начинает сокращаться с большей силой, но увеличения работы при этом не происходит. В результате развивается функциональная недостаточность трехстворчатого клапана. Кровь возвращается в правое предсердие, что приводит к его расширению и падению работы сердца. Все это в конечном итоге приводит к повышению венозного давления, которое в полых венах вместо 90-110 мм водяного столба достигает 300 мм.
Таким образом, даже при наличии компенсаторных реакций при стенозе левого атриовентрикулярного отверстия резко увеличивается внешняя работа сердца, что неизбежно сопровождается недостаточностью кровообращения.
По мере уменьшения размеров митрального отверстия и количества крови, поступающей в сосудистое русло, развивается циркуляторная гипоксия. Длительное кислородное голодание вызывает дистрофические изменения тканей и нарушение функций органов, в первую очередь - головного мозга и миокарда.
Билет №161
Синдром портальной гипертензии - комплекс расстройств, развивающихся в результате нарушения кровотока в портальных сосудах, печеночных венах или нижней полой вене и последующего повышения давления в системе воротной вены. В зависимости от локализации препятствия току крови выделяют внутри- и внепеченочную формы портальной гипертензии.
Внутрипеченочная форма развивается при циррозе печени, когда из-за разрастания соединительной ткани на месте погибших печеночных клеток возникает облитерация печеночных синусоидов и внутрипеченочных кровеносных сосудов. И самое главное – в норме гепатоцит одной стороной повернут в просвет синусоида, а другой стороной смотрит в желчный проток. При циррозе такая архитектоника нарушается, и все гепатоциты смотрят друг на друга.
 Внепеченочная форма – препятствие кровотоку локализуется либо в самой воротной вене и ее крупных ветвях (например, в результате сдавления опухолью или тромбоза), либо в печеночных венах (например, при их тромбозе – синдром Бадда-Киари), или в нижней полой вене (при констриктивном перикардите).
Внепеченочная форма – препятствие кровотоку локализуется либо в самой воротной вене и ее крупных ветвях (например, в результате сдавления опухолью или тромбоза), либо в печеночных венах (например, при их тромбозе – синдром Бадда-Киари), или в нижней полой вене (при констриктивном перикардите).
Увеличение сопротивления кровотоку в портальной вене приводит к повышению давления в этой системе с 5-6 (норма) до 18-20 мм.рт.ст. и выше. При этом кровь из бассейна портальной вены начинает оттекать через существующие венозные коллатерали (порто-кавальные анастомозы), что приводит к расширению вен пищевода и желудка, расширению околопупочных вен (голова медузы) и образованию геморроидальных варикозных узлов. Наиболее клинически значимы – вены пищевода – могут дать массивное кровотечение и даже привести к гибели. Также наблюдается застой крови в селезенке, который приводит к спленомегалии, а после и к увеличению ее функции (гиперспленизму), что приводит к увеличенному разрушению эритроцитов и торможению костномозгового кроветворения с развитием панцитопении. Также характерным признаком цирроза печни служит асцит (патогенез см. картинку выше).
Обструкция внутрипеченочных сосудов сопровождается повышенным лимфообразованием в печени и пропотеванием лимфы в брюшную полость. Кроме того, развивающееся привнутрипеченочной портальной гипертензии повышение синусоидального гидростатического давления в свою очередь обусловливает увеличение транссудации жидкости из кровеносного русла в брюшную полость. Возникающие при циррозе печени гемодинамические нарушения в виду вазодилятации и открытия артерио-венозных анастомозов приводят к снижению эффективного объёма плазмы. Последующее возбуждение волюм-рецепторов стимулирует образование ренина ЮГА почек. Активация системы ренин-ангиотензин-альдостерон ведет к увеличению реабсорбции натрия в канальцах почек. Включению этого фактора способствует также повышение выработки АДГ, активация симпатической системы, снижение образования PgE2 в почках и уменьшение активности калликреин-кининовой системы, возникающее в ответ на снижение эффективного объема плазмы. Наконец, уменьшение онкотического давления, обусловленное снижением синтеза альбуминов в печени, также способствует возникновению асцита и его прогрессированию.
В свою очередь, асцит может осложниться развитием гепато-ренального синдрома, который возникает в ответ на существующие при асците нарушения гемодинамики и характеризуется сокращением сосудов коркового слоя почек и последующим падением клубочковой фильтрации, а также спонтанного бактериального перитонита, являющегося следствием инфицирования асцитической жидкости.
Ренальная ишемия
Ишемические факторы довольно многочисленны в патогенезе острой почечной недостаточности (ОПН). Ишемическая ОПН может быть следствием падения “эффективного” внутрисосудистого объёма (кровотечение, ожоги, рвота) или падения эффективного наполнения артериального русла, но при сохранении общего объёма внеклеточной жидкости (застойная СН, перитонит, анафилактический шок). Локальная ишемия может быть причиной острого тубулярного некроза (тяжелое повреждение канальцевой системы почек) при васкулитах, злокачественной гипертензии.
При ОПН в результате прекращения (или снижения) кровоснабжения почек нарушается сперва функция клубочков
Патогенез ишемической ОПН: пусковой механизм – гипоперфузия почек. Ишемия обуславливает комплекс биохимических изменений в эпителии канальцев и в эндотелии.

Прекращение или уменьшение доступа O2 к клетке, прежде всего, приводит к нарушению функции митохондрий в связи с нарушением синтеза АТФ. Т.к. АТФ снабжает клетки энергией, его падение прямо или косвенно вызывает повреждение клетки (нет АТФ -> не работает K-Na насос -> много Na в клетке, потеря K из клетки; также нарушается выведение Ca из клетки, и увеличивается цитозольный Ca, который расщепляет внутриклеточные белки, липиды, нуклеиновые кислоты и обусловливает нарушения цитоскелета). Ишемическое повреждение эндотелия способствует увеличению проницаемости эндотелия, диффузии плазмы и повышению вязкости крови в сосудах почек. Наряду с этим ишемия влияет на гладкомышечные клетки сосудов, вызывая дисбаланс между продукцией медиаторов, обуславливая вазоконстрикцию и вазодилятацию, способствуя нарушению регуляции внутрипочечного сосудистого тонуса (потеря функциональной интеграции нефрона). Дальнейшая гипоперфузия ->нарушение проксимальных и дистальных канальцев -> нарушение реабсорбции и секреции. Необратимые изменения или некроз клеток -> увеличение проницаемости плазменной части мембраны клетки и развитие закупорки просвета канальцев продуктами распада клеток, образовавшимися цилиндрами, диффузии гломерулярного фильтрата в интерстиций. Последствиями этих процессов являются сдавление канальцев отечным интерстицием с повреждением апикальной части клеток канальцев, дисфункция канальцев, увеличение внутриканальцевого давления, потеря эпителиального барьера и уменьшение скорости гломерулярной фильтрации.
Нарушение функций почек при ишемической ОПН (стадии):
1) Шоковая (критическая)
2) Олигоанурическая
3) Полиурическая
4) Восстановительная
Типовые проявления, независимо от причин:
- некроз паренхимы почки
- Отек интерстиция
- Ишемия коры
- Внутрисосудистое свертывание
Тяжесть функциональных изменений определяется тяжестью повреждения системы канальцев.
Наблюдают значительное падение почечного кровотока, однако отмечена его региональная неоднородность. Критическая стадия короткая, но многое определяет – степень поражения, а ,соответственно, и скорость восстановления. Здесь наблюдается анурия – при этом может умереть от ацидоза, гиперкалиемии и гиперкальциемии (сердцу будет плохо). ! если даст мочу на 5й день – выживет.
Потом полиурическая стадия – характеризуется восстановлением диуреза и полиурией – т.к. нужно восстановить Na-урез. Восстановление диуреза предшествует повышению скорости клубочковой фильтрации . После этого сначала восстанавливаются клубочки, а потом канальцы. Несмотря на восстановление диуреза, концентрационная функция и способность к подкислению может восстанавливаться очень долго, поэтому нужно смотреть за концентрациями ионов в моче, плюс еще это зависит от степени повреждения клеток канальцев (либо они должны выйти просто из некробиоза – тогда восстановление займет окло 2х недель, либо они некротизировались и забили своими остатками просвет нефрона – тогда нужно еще будет ждать, когда придут РОСТОВЫЕ ФАКТОРЫ ИЗ КЛУБОЧКА, вырастут новые клетки канальцев и создадут новый градиент мозгового слоыя). Дальнейшее восстановление функции или прогрессирование функционального дисбаланса зависит от длительности ишемии и балансом между компенсаторными возможностями клеток и тяжестью повреждения. !Пациент с ОПН не умирает от уремии, т.к. в данном случае она не развивается в достаточной степени и не действует достаточно долго (умрет на 5 день от другого). Более того- есть полиурия – нет уремии. Последними восстанавливаются ацидо- и аммонио-генез.
Биохимические показатели при ОПН
1) Повышение креатинина и азота мочевины в крови
2) Метаболический ацидоз изза нарушения экскреции нелетучих кислот, которые ежедневно образуются в результате метаболизма белков. Этому сопутствует накопление в сыворотке сульфатов,фосфатов, падают бикарбонаты
3) Расстройства водно-электролитного баланса (задержка жидкости-> гиперволемия)
4) Гиперкалиемия – изза нарушения экскреции калия- не всегда проявляется клинически, т.к. может быть компенсирована функцией дистальных канальцев и зависит от наличия олигурии. Изменения видны на ЭКГ.
Осложнения – со стороны ССС (из-за сдвига ионов – аритмии, СН из-за гиперволемии), крови (анемия и нарушение тромбоцитов под влиянием увеличения оксида азота), неврологические изза уремии. Также подавляется хемотаксис нейтрофилов, лимфопения и нарушение клеточно-опосредованной иммунной защиты –> присоединение инфекции.
Дата добавления: 2019-03-09; просмотров: 788; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
