Получение редкоземельных металлов
Ещё в 1826 г. шведский химик Карл Мозандер (1797–1858) впервые получил металлический церий восстановлением СеСl3 калием в атмосфере водорода.
Основной металлотермической реакцией получения редкоземельных металлов является реакция восстановления галогенидов (обычно хлоридов) натрием, калием, кальцием и алюминием. Трихлориды самария, европия и иттербия не могут быть восстановлены кальцием до металла, так как образуются устойчивые дихлориды перечисленных металлов.
Гадолиний и иттрий также не удаётся получить восстановлением хлоридов кальцием, так как при температуре, достаточной для расплавления получаемых металлов, хлорид кальция сильно вспенивается, что делает невозможным отделение металла от шлака. Проблема разрешается заменой хлоридов фторидами. Фториды менее гигроскопичны, а в результате восстановления образуется стабильный фторидный шлак, что обеспечивает полное разделение металла и шлака. Кроме того, применение танталовых тиглей сильно снизило загрязнение металла материалом тигля. Методом восстановления фторидов кальцием можно получить все редкоземельные металлы, кроме самария, европия и иттербия.
Шихтовку кальция и фторида редкоземельного металла производят в атмосфере инертного газа. Кальций берут с 10 %-м избытком против требуемого по реакции (R – редкоземельный металл):
3Ca + 2RF3 → 3CaF2 + 2R.
Шихту загружают в танталовый тигель, который закрывают перфорированной танталовой крышкой, помещают в кварцевую трубу вакуумной индукционной печи и медленно нагревают для дегазации до 600 °С. При этой температуре в систему вводят очищенный аргон до остаточного давления 500 мм рт. ст. В зависимости от получаемого металла температуру реакции поддерживают от 800 до 1000 °С. Для разделения металла и шлака температуру в конце процесса поднимают до расплавления компонентов. Желательна температура процесса как минимум на 50 °С выше точки плавления получаемого металла. Для разделения металла и шлака смесь выдерживают 15 мин при этой максимальной температуре. После охлаждения тигля металл извлекают и очищают от шлака. В танталовом тигле диаметром 50 и высотой 200 мм можно выплавить корольки металла массой до 300 г.
|
|
|
В настоящее время разработан промышленный метод получения иттрия высокой чистоты восстановлением фторида кальцием в присутствии магния по схеме:
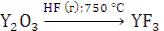
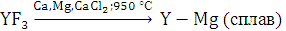
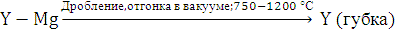
Металлический самарий, европий и иттербий получают методом, основанным на разнице давления пара лантана и значительно более высокого давления пара Sm, Eu и Yb при одинаковой температуре. Шихту, состоящую из окислов Sm2О3, Еu2O3 или YЬ2О3 и лантановой стружки, взятой с 10 %-м избытком, нагревают в вакууме в танталовом тигле. При этом протекает реакция:
|
|
|
2La + Sm2O3 → La2O3 + 2Sm
Нижняя часть тигля, помещенная в зону наивысшей температуры, служит зоной реакции, верхняя – конденсатором, на стенках которого конденсируется восстанавливаемый летучий металл. Используя тигель диаметром 50 мм, за одну операцию получают 300–400 г металла. Верхняя часть тигля изготовлена в виде медного конденсатора, охлаждаемого воздухом. Температура конденсатора 300–400 °С. При этой температуре обеспечивается хороший рост зёрен металла. Слишком низкая температура конденсатора приводит к образованию пирофорного порошкообразного осадка.
Вместо лантана в качестве восстановителя можно использовать церий и даже мишметалл. Увеличение размеров тигля позволяет получить большое количество металла в одной загрузке.
Получение титана
Особенности металлургии титана связаны с его способностью поглощать газы при повышенной температуре и взаимодействовать с материалом реакторов. Многовалентность титана и образование ряда соединений низшей валентности также определяют специфику процесса.
 С термодинамической точки зрения осуществимо восстановление титана из оксидов атомарным водородом, однако использование метода ограничивается серьёзными техническими трудностями, а также возможностью образования гидрида.
С термодинамической точки зрения осуществимо восстановление титана из оксидов атомарным водородом, однако использование метода ограничивается серьёзными техническими трудностями, а также возможностью образования гидрида.
|
|
|
Зависимость реакции:
TiO2 + 2CO → Ti + 2CO2
показывает, что даже при 3000 К lgK = – 5,49. Для процесса восстановления диоксида титана углеродом с выделением СО lgK = 0,98 при 2000 К. Однако при этом одновременно с металлом образуется карбид. Восстановление карбидом кальция невозможно не только из-за образования карбида титана, но и вследствие образования титаната кальция, восстанавливающегося труднее, чем диоксид титана. При сравнительно низкой температуре с достаточной полнотой протекает реакция
TiO2 + 2CaH → Ti + 2CaO +H2 – 7,2 ккал;
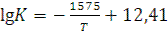 .
.
Однако практического применения этот метод не нашёл.
В качестве восстановителей диоксида титана (в соответствии с зависимостью ΔG° от температуры) можно использовать Аl, Mg, Ca, Zr, Be. Два последних металла не применяют по экономическим соображениям. Реакции восстановления ТiO2 алюминием и магнием описываются уравнениями:
3TiO2 + 4Al → 3Ti + 2Al2O3 – 143 ккал;
TiO2 + 2Mg → Ti + 2MgO – 69 ккал;
Практическое осуществление этих процессов наталкивается на некоторые трудности. При восстановлении магнием образуется ТiO, а не металлический титан. Для успешного проведения процесса необходимо повысить температуру выше 1000 °С, что неприемлемо из-за взаимодействия металлического титана с материалом реактора при этой температуре. Алюминий образует с титаном сплав, удаление восстановителя из которого затруднено. Кроме того, получающийся металл содержит повышенное количество кислорода.
|
|
|
Разрабатывается процесс извлечения титана из ильменитовой руды, включающий её контакт с фторсиликатом щелочного металла и получение фторидов титана с последующим их восстановлением алюминием в присутствии цинка до металла и отгонкой алюминия и цинка из титана в вакууме. Преимуществом процесса является возможность получения титановой губки из дешёвого сырья в непрерывном режиме.
В настоящее время поиск новых эффективных путей производства титановой губки ведётся в направлении создания непрерывных, малопередельных, дешёвых, полностью автоматизированных процессов (в том числе, плазменных) восстановления титана из его тетрахлорида, диоксида, а также ильменитового концентрата.
3.4.1. Восстановление TiCl 4 магнием
В промышленной практике широко используют восстановление хлоридов титана. Восстановление TiCl4 металлами осуществляется в крупномасштабном производстве, поэтому выбор подходящего восстановителя определяется не только термодинамическими данными, но также соображениями экономики и технической осуществимости. Наиболее интересны с этой точки зрения реакции, приведённые в табл. 6.
Таблица 6
Дата добавления: 2019-02-26; просмотров: 399; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
