Температура начала восстановления некоторых оксидов углеродом
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
РОССИЙСКОЙ ФЕДЕРАЦИИ
РОССИЙСКИЙ ХИМИКО-ТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ
ИМЕНИ Д. И. МЕНДЕЛЕЕВА
А. М. Чекмарев
МЕТАЛЛОТЕРМИЯ В ТЕХНОЛОГИИ
РЕДКИХ МЕТАЛЛОВ
Допущено учебно-методическим объединением по образованию в области химической технологии и биотехнологии в качестве учебного пособия для студентов высших учебных заведений, обучающихся по специальности 18.05.02 Химическая технология материалов современной энергетики и смежных специальностей.
Москва
2014
УДК 669.046.85/86 (075)
ББК 34.16я7
Ч-373
Рецензенты:
Доктор химических наук, профессор кафедры технологии редких и рассеянных элементов и материалов на их основе Московской государственной академии химических технологий им. М. В. Ломоносова
А. М. Резник
Доктор химических наук, профессор кафедры химии высоких энергий и радиохимии Российского химико-технологического университета им. Д. И. Менделеева
А. В. Очкин
Чекмарев А. М.
Ч-373 Металлотермия в технологии редких металлов: учебное пособие/
А. М. Чекмарев. – М. : РХТУ им. Д. И. Менделеева, 2014. – 88 с.
ISBN 978-5-7237-1196-9
В пособии представлены сведения по теоретическим основам и истории металлотермии, изменениям энергии Гиббса при образовании оксидов, хлоридов и фторидов. Вводится понятие термичности металлотермической реакции, приведена классификация процессов, описаны способы получения основных металлов – восстановителей – алюминия, магния, кальция, натрия, и кремния, их рафинирования, измельчения, а также об основных физических и химических свойствах. В разделе «Практическое применение» на примере конкретных металлотермических процессов приводятся схемы основных применяемых аппаратов восстановления и очистки продукта. Описано получение лития, бериллия, редкоземельных металлов, титана, циркония (гафния), ниобия, тантала, урана, плутония, тория, а также некоторых легирующих сплавов.
|
|
|
Предназначено для студентов и аспирантов специальности 18.05.02 Химическая технология материалов современной энергетики и смежных специальностей.
УДК 669.046.85/86 (075)
ББК 34.16я7
Учебное издание
ЧЕКМАРЕВ Александр Михайлович
Металлотермия в технологии редких металлов
Редактор Н. А. Заходякина
Подписано в печать г. Формат 60х84 1/16.
Усл. печ. л. 5,12.
Уч.-изд. л. 4,79. Тираж 150 экз. Заказ № 53
Российский химико-технологический университет им. Д. И. Менделеева
Издательский центр
Адрес университета и издательского центра:
125047 Москва, Миусская пл., 9
| ISBN 978-5-7237-1196-9 | © Российский химико-технологический университет им. Д. И. Менделеева, 2014 |
| © Чекмарев А. М., 2014 |
ОГЛАВЛЕНИЕ
|
|
|
| 1. Теоретические основы…………………………………………………….. | 4 | |||
| 2. Металлы-восстановители ………………………………………………... | 19 | |||
| 2.1. Способы получения…………………………………………………. | 19 | |||
| 2.1.1. Алюминии………………………………………………………… | 19 | |||
| 2.1.2. Магний…………………………………………………………….. | 20 | |||
| 2.1.3. Кальций……………………………………………………………. | 21 | |||
| 2.1.4. Натрий……………………………………………………………... | 23 | |||
| 2.1.5. Кремний…………………………………………………………… | 23 | |||
| 2.2. Рафинирование металлов-восстановителей……………………...... | 23 | |||
| 2.3. Измельчение…………………………………………………............. | 25 | |||
| 2.4. Физические свойства……………………………………………....... | 28 | |||
| 2.5. Химические свойства……………………………………………….. | 31 | |||
| 3. Практическое применение металлотермии……………………………... | 33 | |||
| 3.1. Получение лития…………………………………………………….. | 33 | |||
| 3.2. Получение бериллия………………………………………………… | 35 | |||
| 3.3. Получение редкоземельных металлов……………………………... | 38 | |||
| 3.4. Получение титана…………………………………………………… | 40 | |||
| 3.4.1. Восстановление TiCl4 магнием…………………………………... | 41 | |||
| 3.4.2. Восстановление TiCl4 натрием…………………………………... | 53
| |||
| 3.4.3. Восстановление TiО2 кальцием………………………………….. | 56 | |||
| 3.4.4. Восстановление TiО2 гидридом кальция………………………... | 57 | |||
| 3.5. Получение циркония и гафния……………………………………... | 58 | |||
| 3.5.1. Восстановление оксидов…………………………………………. | 58 | |||
| 3.5.2. Восстановление фторидов……………………………………….. | 59 | |||
| 3.5.3. Восстановление хлоридов………………………………………... | 63 | |||
| 3.6. Производство ниобия и тантала……………………………………. | 70 | |||
| 3.6.1. Карботермическое восстановление……………………………… | 70 | |||
| 3.6.2. Восстановление галогенидов…………………………………….. | 71 | |||
| 3.7. Уран, плутоний, торий……………………………………………… | 73 | |||
| 3.8. Легирующие сплавы с редкими металлами……………………….. | 76 | |||
| 3.8.1. Феррониобий……………………………………………………… | 76 | |||
| 3.8.2. Ферротитан………………………………………………………... | 78 | |||
| 3.8.3. Ферровольфрам…………………………………………………… | 80 | |||
| 3.8.4. Грейнал……………………………………………………………. | 81 | |||
| 3.9. Термитная сварка……………………………………………………. | 81 | |||
| 3.10. Получение огнеупорных материалов…………………………….. | 83 | |||
| 3.11. Высокотемпературные процессы………………………………… | 83 | |||
| Приложение………………………………………………………............. | 85
| |||
| Литература…………………………………………................................... | 88 | |||
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ
Металлотермия – это процесс восстановления металлов из их соединений другими металлами, химически более активными, при повышенной температуре. Иногда сюда включают также процессы восстановления неметаллами.
Многие редкие элементы впервые получены и производятся в настоящее время в больших масштабах металлотермическим методом, который отличается относительной простотой процессов и технологического оборудования.
В 1859 г. Николай Николаевич Бекетов (рис. 1), основатель Харьковской школы физико-химиков, находился в заграничной научной командировке. Работая в парижской лаборатории Ж. Дюма, он выполнил научную работу, во многом определившую направление его дальнейших исследований. Учённый рассуждал следующим образом: если многие металлы вытесняют (восстанавливают) водород из кислот, то водород под давлением должен вытеснять металлы из растворов их солей. И действительно, Бекетов установил, что водород в газообразном состоянии может выделять некоторые металлы (серебро, ртуть) из растворов их хлоридов и что действие водорода зависит от его давления и от концентрации раствора.

Рис. 1. Николай Николаевич Бекетов (1827 – 1911 гг.)
11 марта 1859 г. Н. Н. Бекетов сделал доклад «О некоторых явлениях восстановления» на заседании Парижского химического общества. В докладе, кроме явлений, связанных с действием водорода, сообщалось о возможности восстановления бария из оксидов металлическим алюминием.
Бекетов писал: «Выделение одних элементов другими из соединений … обнаруживает в самом простом виде то, что называется химическим сродством, тотчас указывая на химическое различие элементов, чего не обнаруживают явления прямого соединения…».[1] Иными словами, здесь учённый сформулировал основное положение металлотермии: более активные металлы восстанавливают менее активные из их соединений.
Н. Н. Бекетов осуществил восстановление кремния цинком, бария – алюминием. По его мнению, этот метод «окажется удобным для практики, так как цена алюминия не высока».
В 1898 г., т.е. почти на сорок лет позже Бекетова, в работе «Новый способ получения металлов, сплавов и т.д.» немецкий учённый Г. Гольдшмидт описал алюмотермический метод восстановления металлов из их оксидов (в частности, оксид железа был восстановлен алюминием до свободного металла). Опыты были повторены во многих лабораториях мира, и способ высоко оценивался в связи с простотой выполнения и возможностью достижения высоких температур. Однако неоспоримо то, что идея использования алюминия как восстановителя и начала теоретических основ процесса, названного металлотермией, всецело принадлежит Н. Н. Бекетову. Впоследствии советские учёные (под руководством академика А. Г. Мержанова) расширили рамки применения металлотермического процесса: в реакционную смесь кроме исходного соединения и металла-восстановителя добавляли соединения или элементы, образующие с восстанавливаемым металлом разнообразные технически важные материалы. Такой метод получил название «самораспространяющийся высокотемпературный синтез» (СВС). Легко, однако, видеть, что в основе СВС лежит всё та же металлотермическая реакция, которая, собственно и является «самораспространяющийся».
При разработке высокотемпературных химико-технологических процессов обычно производят предварительную оценку вероятности протекания тех или иных реакций, а также соотношения продуктов реакции и исходных веществ в состоянии равновесия – константы равновесия.
Реакцию металлотермического восстановления в общем виде можно представить уравнением:
Me'X + Me'' → Me''X + Me' + ΔH,
где X – анион; ΔΗ – тепловой эффект.
Протекание реакции в сторону образования продуктов (восстановление Me') возможно при условии:
ΔG°T = (ΔG°T, Me''X – ΔG°T, Me'X) < 0,
где ΔG°T,Me'X – энергия Гиббса реакций образования соединений Ме'Х из элементов при температуре реакции. Обычно считается, что в случае, когда ΔG°T > 0, реакция не идёт. Однако Кр больше нуля при любом значении ΔG°T и при контакте исходных веществ (Ме'Х + Ме") в любом случае получается какое-то количество продуктов реакции (минимальное для ΔG°T > 0). Если при этом возможно осуществление процесса с отводом восстанавливаемого металла (восстановление летучего металла в вакууме), реакция протекает достаточно полно даже в случае положительного значения ΔG°T, и возможность технологического её осуществления определяется в основном экономическими соображениями.
Сдвиг величины ΔG в нужную сторону можно осуществить, если обеспечивается связывание образующегося продукта (Ме″Х), например, его отшлакование. Иногда для этой цели в исходную смесь специально вводят вещество, образующее устойчивые легкоплавкие соединения nМе″′Х·mМе″Х.
Изменение энергии Гиббса вычисляют обычными методами. Для приближенной оценки возможности протекания реакции восстановления удобно пользоваться диаграммами (рис. 2 – 4), на которых приведены значения стандартной энергии Гиббса реакций Me + X → MeX.




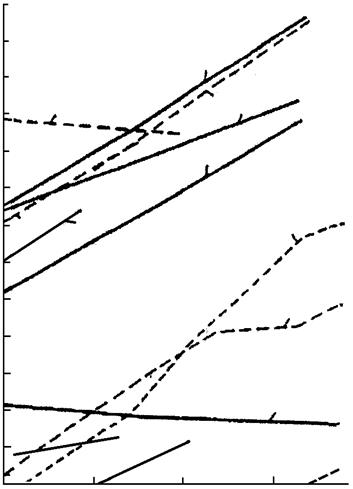
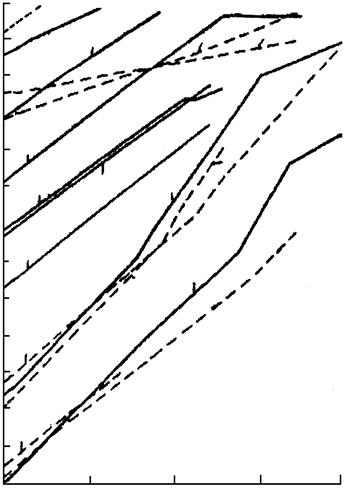
Рис. 2. Зависимость стандартной свободной энергии образования фторидов из элементов от температуры


Рис. 3. Стандартные свободные энергии образования оксидов из элементов
(в скобках нестехиометрические соединения)

|

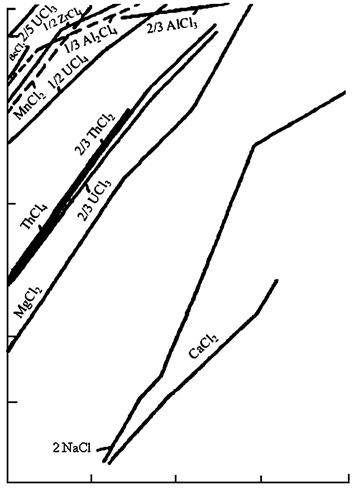
Рис. 4. Зависимость стандартной свободной энергии образования хлоридов из элементов от температуры
Чем больше по абсолютному значению (чем более отрицательна энергия Гиббса) ΔG° образования данного соединения, тем более оно устойчиво и тем сильнее восстановительная способность металла, входящего в это соединение. Все значения энергии Гиббса образования (рис. 2 – 4) рассчитаны не на моль образующегося соединения, а на моль газа, принимающего участие в реакции, например, по уравнениям:
½Ti + F2 → ½TiF4;
Mg + F2 → MgF2
и т.п., что делает их сопоставимыми.
Практически во всех случаях абсолютное значение ΔG° с повышением температуры уменьшается, что говорит об уменьшении прочности соединений, стремлении их к диссоциации.
Зависимость ΔG° от температуры имеет вид степенного ряда, однако кривые приведённых диаграмм приближаются к прямым в тех пределах, где отсутствуют фазовые превращения металла или соли. В точках плавления, кипения и аллотропического перехода эти прямые претерпевают излом и приобретают другой наклон. Принимая в первом приближении величину ΔН° не зависящей от температуры, легко показать, что угловой коэффициент каждого участка прямой приблизительно равен отрицательному значению изменения энтропии: 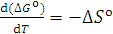 . В соответствии с закономерностями изменения энтропии системы прямая претерпевает излом вверх при фазовом превращении металла и вниз при превращении соединения. Изломы резче всего в точках кипения (из-за резкого изменения энтропии системы при образовании газовой фазы). В точках полиморфного превращения изломы незначительны.
. В соответствии с закономерностями изменения энтропии системы прямая претерпевает излом вверх при фазовом превращении металла и вниз при превращении соединения. Изломы резче всего в точках кипения (из-за резкого изменения энтропии системы при образовании газовой фазы). В точках полиморфного превращения изломы незначительны.
Определённость понятий металл-восстановитель и восстанавливаемый металл относительна, так как после пересечения кривых (прямых) зависимости ΔG° от Т элементы меняются местами и реакция идёт в сторону вытеснения (восстановления) металла, который до пересечения являлся восстановителем. В пределах твёрдого и жидкого состояний металлов и их соединений угловые коэффициенты прямых чаще всего близки и эти прямые практически не пересекаются. Следовательно, вплоть до точек кипения металлов и их солей повышение температуры редко изменяет последовательность вытеснения одних металлов другими, но последовательность часто изменяется при температуре выше точки кипения.
Кривая изменения энергии Гиббса при образовании СО (рис. 3) имеет обратный наклон по отношению к другим кривым, поэтому углеродом при достаточно высокой температуре можно восстановить практически все металлы из оксидов (табл. 1), однако, к сожалению, при этом чаще получаются стойкие карбиды, а не чистые металлы.
Положение кривых рис. 2 – 4 определяет также возможность рафинирования металлов избирательным образованием соединений металлов-примесей с последующим их отшлакованием. Действительно, металлы-примеси, обладающие большими абсолютными значениями ΔG° образования (например, оксидов) могут быть переведены в шлак избирательным окислением. Возможно удаление, например, Са и Mg из А1-сплавов продуванием кислорода, однако удаление Zr, Ti и др. таким путём осуществить не удаётся, так как сначала должен образоваться оксид очищаемого металла.
Таблица 1
Температура начала восстановления некоторых оксидов углеродом
| Оксид | Температура, °С | Оксид | Температура, °С | ||
| при давлении 760 мм рт. ст. | в вакууме | при давлении 760 мм рт. ст. | в вакууме | ||
| V2O5 | – | 650 | Та2О5 | – | 1100 |
| Сr2O3 | 1105 | 690 | SiO2 | 1460 | 1250 |
| La2O3 | – | 700 | ВеО | – | 1315 |
| UO2 | 1480 | 800 | MgO | 1800 | 1350 |
| СеО2 | – | 800 | Аl2O3 | 1950 | 1350 |
| TiO2 | – | 1100 | ThO2 | 1600 | 1380 |
Расположение кривой для АlСl3 показывает термодинамическую невозможность удаления из алюминиевых сплавов примесей титана избирательным хлорированием. Данные диаграмм ΔG° = f(T) определяют также возможность применять добавки одних металлов для «раскисления» (удаления вредных примесей) других.
Из рис. 2 – 4 можно сделать вывод, что кальций является лучшим восстановителем металлов из их оксидов, хлоридов и фторидов. Однако при выборе восстановителя необходимо принимать во внимание экономические показатели процесса, а также технологические условия. Для получения чистого металла необходимо, чтобы восстановитель не образовывал с ним устойчивых сплавов и соединений, а избыток восстановителя и шлак легко отделялись (механическим путём, отшлакованием, отмывкой, отгонкой и т.п.). Необходимо, чтобы стоимость полученного металла оправдывала расходы на восстановитель.
Количество тепла, выделяемого в металлотермическом процессе, определяется как разность теплот образования соединений из элементов.
Часто энергия Гиббса реакции определяет принципиальную возможность её протекания при низкой температуре с достаточной полнотой, однако скорость реакции может оказаться настолько низкой, что практическое её осуществление становится невозможным. Выделяемое тепло при этом рассеивается без заметного повышения температуры системы. Чтобы обеспечить повышение температуры реакционной массы за счёт выделяющегося тепла, необходима минимальная температура tн – температура начала реакции. По достижении tн хотя бы в одной точке реакция распространяется по всему объёму исходной смеси и температура повышается до максимальной tт.р. – температуры реакции.
Для определения теоретической температуры реакции необходимо составить тепловой баланс процесса по схеме: провести реакцию при 298 К с выделением ΔΗ298, затем нагреть продукты реакции этим теплом до искомой температуры tт.р., учитывая теплоты полиморфных превращений, плавления, испарения продуктов реакции, теплоты растворения Me" в Me' и в Me"X и т.д., составить уравнение теплового баланса и решить его относительно tт.р. При этом следует учитывать зависимость теплоёмкостей от температуры. Поскольку весь объём необходимых сведений далеко не всегда доступен, проведение подобного расчёта представляется весьма сложной задачей.
Расчёт справедлив для случая больших значений константы равновесия реакции восстановления, когда равновесным количеством исходных веществ можно пренебречь. Для реакции с избытком восстановителя необходимо учитывать растворение избытка восстановителя в Me' и шлаке Ме"Х и т.п. Если tт.р. > tкип шлака, надо включить в расчёт теплоту испарения шлака.
Практически получаемая температура меньше расчётного значения tт.р. из-за потерь тепла за время прохождения реакции и зависит от конструкции реактора, скорости процесса и других факторов. Увеличение масштаба плавки способствует относительному уменьшению валовых потерь тепла. Сокращению потерь способствуют также уменьшение удельного объёма шихты, повышение скорости реакции, теплоизоляция стенок реактора и т.п. Если условия проведения процесса требуют достижения определённой температуры (например, для получения восстанавливаемого металла в расплавленном состоянии), применяют подогревающие (греющие, тепловыделяющие) добавки, часто состоящие из соединений, реагирующих с восстановителем с большим выделением тепла. Перегрев шихты может привести к бурному парообразованию (кипению) одного или нескольких компонентов реакционной смеси и выбросу реакционной смеси. В этом случае применяют охлаждающие добавки, в качестве которых могут служить избыток восстановителя или инертные (разбавляющие) материалы.
Для приближённой оценки развиваемой в процессе реакции восстановления температуры можно пользоваться величиной термичности Т, выражающей количество тепла, выделяющегося на 1 г шихты:
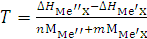 ,
,
где ΔΗ – тепловые эффекты образования соединений МеХ; nMMe″ и mMMe'X – значения молекулярной массы реагирующих веществ, взятые в стехиометрическом соотношении (n:m).
В табл. 2 приведены значения термичности процессов восстановления оксидов некоторых редких металлов магнием.
Использование низкокипящих восстановителей (например, магния: tкип = 1107 °С) не позволяет проводить процессы восстановления в вакууме (вследствие увеличения потерь металла). В этом случае необходимо создавать повышенное давление инертного газа, поскольку сохранение в системе воздуха приводит к образованию оксидов и нитридов, загрязняющих восстанавливаемый металл.
Отрицательная термичность относится к процессам, в которых теплота образования соединения (оксида) восстанавливаемого металла больше ΔН образования оксида металла-восстановителя.
Таблица 2
Дата добавления: 2019-02-26; просмотров: 670; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
