Література для оформлення роботи і підготовки
теоретичного матеріалу
Опрацювати підрозділ 10.8 підручника [6] та підрозділи 3.2.6, 3.2.7 посібника [3].
Лабораторна робота 8 Комплексні сполуки
Теоретична частина
Комплексними називають сполуки, у вузлах кристалічних ґраток яких містяться комплексні йони, що зберігаються при розчиненні або розплавленні сполуки. Реакції, у результаті яких утворюються комплексні сполуки, називаються реакціями комплексоутворення, наприклад:
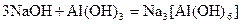 ,
,
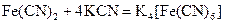 .
.
У водних розчинах комплексні сполуки дисоціюють як сильні електроліти з утворенням комплексних йонів:
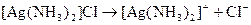 .
.
Комплексні йони дисоціюють оборотно: 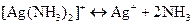 .
.
Дисоціацію комплексних йонів можна охарактеризувати константою рівноваги, яка називається константою нестійкості 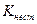 . Чим менша константа нестійкості, тим більш міцним є комплексний йон. Для йона
. Чим менша константа нестійкості, тим більш міцним є комплексний йон. Для йона 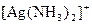 вираз константи нестійкості має такий вигляд:
вираз константи нестійкості має такий вигляд:
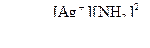
Найбільш поширеною є класифікація комплексних сполук за видом координованих лігандів. За цією ознакою розрізняють аквакомплекси, в яких лігандами є молекули води, наприклад: 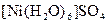 ; ацидокомплекси, в яких лігандами є аніони кислотних залишків, наприклад:
; ацидокомплекси, в яких лігандами є аніони кислотних залишків, наприклад: 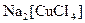 , гідроксокомплекси, в яких лігандами є гідроксид-аніони, наприклад:
, гідроксокомплекси, в яких лігандами є гідроксид-аніони, наприклад: 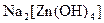 , амінокомплекси, в яких лігандами є молекули амоніаку, наприклад
, амінокомплекси, в яких лігандами є молекули амоніаку, наприклад 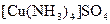
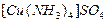 , тощо.
, тощо.
Контрольні запитання і вправи
1 З яких частинок складається комплексна сполука? Які частинки є комлексоутворювачами в комплексному йоні? Що показує координаційне число в комплексному йоні?
|
|
|
2 Визначити ступінь окиснення та координаційне число комплексоутворювача в таких сполуках: 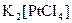 ,
, 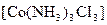 ,
, 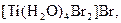
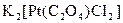 .
.
3 Який із наведених комплексних йонів є найбільш стійким:
а) 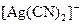 ,
, 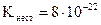 ;
;
б) 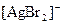 ,
, 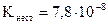 .
.
Практична частина
Мета роботи: отримати комплекси різного типу, дослідити їх властивості.
Обладнання і реактиви: мікрошпатель, пробірки, порцелянова чашка, нагрівний прилад, промивалка з дистильованою водою, мідний купорос, сіль Мора, кобальт(ІІ) хлорид гексагідрат, олово гранульоване, розчини: натрій гідроксиду (0,5 Н), хлоридної кислоти (2 Н), сульфатної кислоти (2 Н), купрум(ІІ) сульфату (0,5 Н), алюміній сульфату (0,5 Н), барій хлориду (0,5 Н), цинк сульфату (0,5 Н), натрій хлориду(0,5 Н), калій гексаціаноферату(ІІ) (0,5 Н), амоній гідроксиду (25%), аргентум нітрату (0,1 Н), натрій тіосульфату (0,5 Н).
ДОСЛІД 3.8.1 Добування і дослідження комплексної сполуки тетраамінкупрум(ІІ) сульфату
Налити у три пробірки по 1 млрозчину купрум(ІІ) сульфату. У першу пробірку долити розчин барій хлориду до появи осаду. Який колір осаду? Про наявність якого йона в розчині купрум(ІІ) сульфату свідчить поява осаду?
|
|
|
У другу пробірку внести шматочок гранульованого олова, через 5-10 хвилин спостерігати виділення червоного нальоту на поверхні олова. Про наявність якого йона в розчині купрум(ІІ) сульфату свідчить поява осаду?
У третю пробірку по краплях додавати розчин амоній гідроксиду. Спочатку спостерігати утворення осаду купрум(ІІ) гідроксосульфату, а потім розчинення цього осаду при утворенні тетраамінкупрум(ІІ) сульфату. Отриманий розчин розлити порівну у дві пробірки і провести в них досліди, аналогічні проведеним із купрум(ІІ) сульфатом. Чи випадає осад при додаванні барій хлориду? Чи виділяється мідь на поверхні олова?
Скласти рівняння всіх проведених хімічних реакцій. Порівняти відношення середньої та комплексної солей купруму(ІІ) до кожного з реактивів, які додавали. За результатами дослідів скласти рівняння електролітичної дисоціації середньої та комплексної солей купруму(ІІ).
ДОСЛІД 3.8.2 Властивості аквакомплексів
А У порцелянову чашку помістити 1-2 мікрошпателі мідного купоросу. Обережно прожарити вміст порцелянової чашки. Звернути увагу на зміну кольору кристалів. Коли порцелянова чашка охолоне, додати 1-2 краплі води, відмітити зміну забарвлення розчину. Скласти рівняння реакцій.
|
|
|
Б Упробірку насипати 1-2 мікрошпателі кобальт(ІІ) хлориду гексагідрату, обережно нагріти. Спостерігати зміну забарвлення, що відповідає реакції відщеплення води:
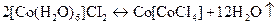 .
.
Охолодити пробірку і додати декілька крапель розчину натрій гідроксиду. Записати спостереження.
ДОСЛІД 3.8.3 Добування і властивості ацидокомплексів
А У пробірку налити 0,5 мл розчину натрій хлориду і додати розчин аргентум нітрату (0,5 Н). Спостерігати утворення осаду. Потім по краплях додавати розчин натрій тіосульфату до повного розчинення осаду. Скласти рівняння реакції добування дитіосульфатаргентату натрію (координаційне число йона 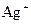 дорівнює 2).
дорівнює 2).
Б У пробірку налити 0,5 мл розчину купрум(ІІ) сульфату і додати такий самий об’єм калій гексаціаноферату(ІІ). Відмітити колір утвореного осаду і скласти рівняння хімічних реакцій.
ДОСЛІД 3.8.4 Утворення гідроксокомплексів
У три пробіркиналити по 1 мл розчинів: у першу – цинк сульфату, у другу – хром(ІІI) сульфату, у третю – алюміній сульфату. У кожну з них по краплях додавати розчин натрій гідроксиду до випадіння осадів. Потім долити надлишок лугу, спостерігати розчинення осадів. Скласти рівняння проведених реакцій. Врахувати, що при розчиненні осадів утворюються гідроксокомплекси, які містять такі йони: 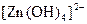 ,
, 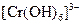 ,
, 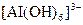 .
.
|
|
|
Дата добавления: 2019-02-13; просмотров: 129; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
