Література для оформлення роботи і підготовки
теоретичного матеріалу
Опрацювати розділ 13 підручника [6] та структурно-логічну схему 3.7 (стор.260-270) посібника [3].
Лабораторна робота 9 Окисно-відновні реакції
Теоретична частина
Окисно-відновними (ОВР) називають реакції, які відбуваються зі зміною ступеня окиснення атомів реагентів. Зміна ступеня окиснення пов`язана з переходом електронів або зміщенням електронних пар до найбільш електронегативного атому. Процес віддачі електронів атомом, молекулою, йоном називається окисненням, а процес приєднання електронів – відновленням. Атоми, молекули або йони, які віддають електрони, називаються відновниками, а ті, що приєднують, – окисниками.
Стан атомів у молекулі характеризує його ступінь окиснення. Ступінь окиснення – це умовний заряд атома в молекулі, розрахований виходячи з припущення, що молекула складається з йонів. Ступінь окиснення може мати позитивне, негативне та нульове значення. Атоми одного й того ж самого елемента в різних сполуках виявляють різні значення ступеня окиснення. Розглянемо приклади ступенів окиснення Карбону в таких сполуках:
 ,
,  ,
,  ,
,  ,
,  .
.
До типових окисників відносять кисень, галогени, а також сполуки, що містять у своєму складі атоми у вищому ступені окиснення, наприклад  ,
,  ,
,  ,
,  ,
,  . До типових відновників відносять водень, метали і сполуки, що містять у своєму складі атоми у нижчому ступені окиснення, наприклад
. До типових відновників відносять водень, метали і сполуки, що містять у своєму складі атоми у нижчому ступені окиснення, наприклад  ,
,  ,
,  . Речовини, які у своєму складі містять атоми у проміжному ступені окиснення, наприклад
. Речовини, які у своєму складі містять атоми у проміжному ступені окиснення, наприклад  ,
,  ,
,  , залежно від реагента, з яким вступають у взаємодію, здатні виявляти як окисні, так і відновні властивості.
, залежно від реагента, з яким вступають у взаємодію, здатні виявляти як окисні, так і відновні властивості.
|
|
|
Окисно-відновні реакції поділяють на: міжмолекулярні, внутрішньомолекулярні та диспропорціонування.
До міжмолекулярних відносять такі, в яких елементи окисника та відновника входять до складу різних речовин, наприклад:
 ,
,

До внутрішньомолекулярних відносять такі, в яких елементи окисника та відновника входять до складу однієї речовини, наприклад:
 .
.
До реакцій диспропорціонування відносять такі, в яких частина атомів одного й того ж елемента окиснюється, а інша частина – відновлюється, наприклад:
 ,
,
 .
.
Контрольні запитання і вправи
1 Які реакції називають окисно-відновними? Назвіть типи окисно-відновних реакцій?
2 Які з перелічених речовин: 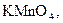


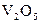 ,
,  ,
, 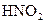 – здатні виявляти як окисні, так і відновні властивості? Відповідь поясніть.
– здатні виявляти як окисні, так і відновні властивості? Відповідь поясніть.
3 У наведених схемах реакцій розставте коефіцієнти методом електронного балансу і зазначте тип ОВР:
а)  ;
;
б)  ;
;
в) 
Практична частина
Мета роботи –дослідити окисно-відновні властивості речовин.
|
|
|
Обладнання і реактиви: мікрошпатель, пробірки, промивалка, натрій сульфіт, калій нітрит, калій бромід, калій йодид, купрум(ІІ) нітрат тригідрат, розчини: етилового спирту (95%), калій гідроксиду (0,5 Н), сульфатної кислоти (1,89 г/см3, 2 Н), калій гексаціаноферату(ІІ) (0,5 Н), калій дихромату (0,5 Н), калій перманганату (0,5 Н), калій йодиду (0,5 Н), купрум(ІІ) сульфату(0,5 Н).
ДОСЛІД 3.9.1 Характер відновлення калій перманганату залежно від реакції середовища
Налити у три пробірки по 1 млрозчину калій перманганату, потім у кожну пробірку налити по 1 мл: у першу – сульфатної кислоти (0,5 Н), у другу – дистильованої води, у третю – калій гідроксиду. В кожну пробірку насипати по одному мікрошпателю натрій сульфіту. Спостерігати зміну забарвлення у кожній пробірці.
Скласти рівняння реакцій між калій перманганатом та натрій сульфітом у кислому, нейтральному, лужному середовищах, розставити в них коефіцієнти методом електронного балансу. Зробити висновок про вплив середовища на окисні властивості калій перманганату.
ДОСЛІД 3.9.2 Відновні властивості галогені дів
Увага! Дослід необхідно виконувати у витяжній шафі!
У дві пробірки насипати по 1 мікрошпателю: у першу - калій броміду, у другу – калій йодиду. В кожну пробірку додати по декілька крапель концентрованої сульфатної кислоти. Спостерігати за зміною забарвлення у пробірках, звернути увагу на запах газів, що виділяються ( сірчистий газ та сірководень).
|
|
|
Скласти рівняння хімічних реакцій, розставити в них коефіцієнти методом електронного балансу. Зробити висновок про відновну активність галогенідів.
ДОСЛІД 3.9.3 Окисно-відновні властивості елементів у проміжному ступені окиснення
Налити в одну пробірку 1 мл розчину калій перманганату, підкислити його розбавленим розчином сульфатної кислоти і додати 1 мікрошпатель калій нітриту. Спостерігати знебарвлення розчину.
У другу пробірку налити 1 мл розчину калій йодиду, підкислити його розбавленим розчином сульфатної кислоти і додати 1 мікрошпатель калій нітриту. Спостерігати зміну забарвлення розчину та виділення газу.
Як пояснити явища, що спостерігаються? В якому випадку нітрит-іони виявляють відновні, а в якому – окисні властивості?
Скласти рівняння хімічних реакцій, розставити в них коефіцієнти методом електронного балансу. Врахувати, що в даному досліді при відновленні нітрит-іонів виділяється азот, а при їх окисненні утворюються нітрат-іони. Зробити висновок про причини і умови прояву окисно-відновної двоїстості калій нітриту.
|
|
|
ДОСЛІД 3.9.4 Комплексні сполуки в окисно-відновних реакціях
Налити в одну пробірку 1 мл розчину калій перманганату, підкислити його розбавленим розчином сульфатної кислоти і додавати розчин калій гексаціаноферату(ІІ) до знебарвлення розчину.
Скласти рівняння хімічної реакції, розставити в ньому коефіцієнти методом електронного балансу. Зробити висновок про причини прояву відновних властивостей калій гексаціаноферату(ІІ).
ДОСЛІД 3.9.5 Органічні сполуки в окисно-відновних реакціях
Увага! Дослід необхідно виконувати у витяжній шафі!
Налити в пробірку 1 мл розчину калій дихромату, долити 0,5 мл розчину концентрованої сульфатної кислоти і додати 5-10 крапель етилового спирту. Обережно збовтати пробірку. Спостерігати за зміною забарвлення і запаху.
Скласти рівняння хімічної реакції, розставити в ньому коефіцієнти методом електронного балансу. Зробити висновок про окисно-відновні властивості органічних сполук.
ДОСЛІД 3.9.6 Внутрішньомолекулярні окисно-відновні реакції
Увага! Дослід необхідно виконувати у витяжній шафі!
У пробірку внести декілька кристаликів купрум(ІІ) нітрат тригідрату (  ). Закріпити пробірку у штативі і обережно нагрівати. Спостерігати за зміною кольору кристаликів і за кольором газу, який виділяється.
). Закріпити пробірку у штативі і обережно нагрівати. Спостерігати за зміною кольору кристаликів і за кольором газу, який виділяється.
Скласти рівняння хімічної реакції розкладу купрум(ІІ) нітрату, враховуючи забарвлення можливих продуктів реакції: безводний  – білий,
– білий, 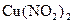 – не існує,
– не існує,  – чорний,
– чорний,  – червоний,
– червоний,  ,
,  ,
,  -– безбарвні гази,
-– безбарвні гази,  - бурий. Розставити коефіцієнти методом електронного балансу, вказати окисник та відновник у складі купрум(ІІ) нітрату.
- бурий. Розставити коефіцієнти методом електронного балансу, вказати окисник та відновник у складі купрум(ІІ) нітрату.
Дата добавления: 2019-02-13; просмотров: 110; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
