Література для оформлення роботи і підготовки
теоретичного матеріалу
Опрацювати розділ 7 підручника [6] та підрозділ 2.2.6 посібника [3].
Лабораторна робота 4 Розчинність речовин. Властивості розчинів
Теоретична частина
Здатність речовини розподілятися в іншій речовині у вигляді атомів, йонів або молекул з утворенням термодинамічно стійкої системи змінного складу називається розчинністю.
Розчином називають гомогенну систему змінного складу, що складається з двох або більшого числа компонентів.
Концентрація насиченого розчину є мірою розчинності речовини, яку виражають масою речовини, що міститься у 100 г розчинника при даній температурі. Розчин називається насиченим, якщо він перебуває в термодинамічній рівновазі з осадом розчиненої речовини .
Якщо в рідині розчинена нелетка речовина, то тиск насиченої пари над розчином менше, ніж над чистим розчинником. Одночасно зі зниженням тиску пари над розчином спостерігається зміна його температури кипіння та замерзання; температури кипіння розчинів підвищуються, а температури замерзання знижуються порівняно з температурами, які характеризують чисті розчинники.
Відносне зниження температури замерзання або відносне підвищення температури кипіння розчину пропорційне його концентрації:
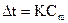 ,
,
де 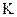 – константа розчинника (кріоскопічна
– константа розчинника (кріоскопічна 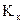 або ебуліоскопічна
або ебуліоскопічна 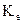 );
);  –моляльна концентрація розчину.
–моляльна концентрація розчину.
|
|
|
Оскільки 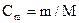 , де
, де  - маса речовини (г) в 1000 г розчинника;
- маса речовини (г) в 1000 г розчинника; 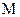 – молярна маса, наведене рівняння можна подати у вигляді:
– молярна маса, наведене рівняння можна подати у вигляді:
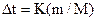 ,
, 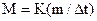 .
.
Отже використовуючи табличне значення величини 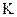 для розчинника, визначаючи масу речовини та
для розчинника, визначаючи масу речовини та 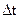 у приладі, можна розрахувати
у приладі, можна розрахувати 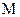 розчиненої речовини.
розчиненої речовини.
Молярна маса розчиненої речовини може бути також визначена способом вимірювання осмотичного тиску розчину (π) та розрахована за рівнянням Вант-Гоффа:
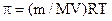 ,
, 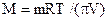 .
.
Контрольні запитання і вправи
1 Які фактори впливають на розчинність речовин?
2 Які види міжмолекулярної взаємодії містить в собі процес розчинення: а) амоніаку у воді; б) сірки у бензені?
3 Температура кипіння водного розчину сахарози  дорівнює 101,40 С . Розрахуйте моляльну концентрацію сахарози і температуру замерзання її розчину (
дорівнює 101,40 С . Розрахуйте моляльну концентрацію сахарози і температуру замерзання її розчину ( 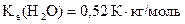 ;
; 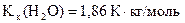 ).
).
Практична частина
Мета роботи –ознайомитися з фізико-хімічною природою процесу розчинення, розчинністю речовин, різними видами розчинів.
Обладнання і реактиви: шпатель,пробірки, термометр, нагрівний прилад, етиловий спирт, тетрахлорометан, бензен, йод; натрій гідроксид, амоній нітрат, натрій ацетат, гліцерин, охолоджувальна суміш солі з льодом.
|
|
|
ДОСЛІД 3.4.1 Утворення сольватів та гідратів
Увага! Досліди проводити у витяжній шафі!
А У чотири пробірки налити по 1 мл: у першу – етиловий спирт, у другу – дистильовану воду, у третю – тетрахлорометан, у четверту – бензен. У кожну пробірку внести невеличку кількість кристаликів йоду, третю і четверту пробірки одразу закрити пробками і збовтати пробірки. Відмітити колір та інтенсивність забарвлення розчинів залежно від розчинника.
Б Декілька кристаликів йоду помістити у велику пробірку і нагріти. Звернути увагу на колір парів йоду, порівняти його із забарвленням розчинів. Чим пояснюється відмінність забарвлення пари йоду порівняно із забарвленням його розчинів?
ДОСЛІД 3.4.2 Теплові ефекти при розчиненні
А Пробірку на 1/4 заповнити водою і виміряти її температуру. Внести у пробірку 1-2 мікрошпателі натрій гідроксиду. Ретельно збовтати пробірку і виміряти температуру розчину.
Б Провести аналогічний дослід із амоній нітратом.
Зробити висновок про теплові ефекти при розчиненні твердих речовин.
ДОСЛІД 3.4.3 Пересичені розчини
Пересичений розчин натрій ацетату готують з розрахунку трьох об’ємних частин солі на одну об’ємну частину води.
|
|
|
У велику пробірку помістити кристали натрій ацетату і додати відповідний об’єм води. Вміст пробірки нагріти на слабкому полум’ї до повного розчинення солі. Охолодити пробірку під струменем холодної води. Додати до розчину декілька крапель гліцерину, що сприятиме утворенню кристалів більшого розміру. Внести декілька кристалів натрій ацетату в охолоджений розчин і спостерігати процес кристалізації розчиненої речовини. Відмітити тепловий ефект процесу.
Повторно нагріти вміст пробірки до повного розчинення солі і охолодити розчин. Викликати кристалізацію розчину за рахунок тертя скляною паличкою по стінці пробірки.
Зробити висновок про спосіб приготування пересиченого розчину та тепловий ефект процесу кристалізації.
Дата добавления: 2019-02-13; просмотров: 111; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
