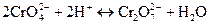Речовин на швидкість хімічної реакції у гетерогенній системі
Взяти два маленьких приблизно однакових шматочки крейди. Один із них покласти на фільтрувальний папірець і скляною паличкою подрібнити до порошкоподібного стану. Отриманий порошок помістити у пробірку. Інший шматочок крейди помістити в іншу пробірку. В обидві пробірки одночасно додати однакову кількість (1 мл) хлоридної кислоти (ρ=1,19 г/см3). Відмітити час повного розчинення крейди в кожному випадку за секундоміром.
Скласти рівняння відповідної хімічної реакції. Зробити висновок про вплив поверхні реагуючих речовин на швидкість хімічної реакції у гетерогенній системі.
Література для оформлення роботи і підготовки
теоретичного матеріалу
Опрацювати підрозділи 6.1.1-6.1.4 підручника [6] та 2.2.1-2.2.4 посібника [3].
Лабораторна робота 3 Хімічна рівновага
Теоретична частина
Хімічна рівновага – це такий стан системи, при якому швидкості прямої і зворотної реакцій однакові, а концентрації всіх речовин у системі залишаються незмінними.
В оборотних хімічних реакціях рівновага встановлюється у той момент, коли відношення добутку концентрацій продуктів, взятих у степенях, що дорівнюють їх стехіометричним коефіцієнтам, до добутку концентрацій реагентів, також піднесених до відповідних степенів, дорівнює певній сталій величині, яка називається константою хімічної рівноваги.
Для оборотної реакції
|
|
|
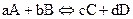
константа хімічної рівноваги
 .
.
Константа хімічної рівноваги залежить від природи реагуючих речовин та від температури. Концентрації, при яких встановлюється рівновага, називаються рівноважними. Зміна зовнішніх умов (концентрації, температури, тиску) призводить до зміщення хімічної рівноваги у системі і переходу її до нового стану.
Напрямок зміщення хімічної рівноваги визначається принципом Ле Шательє - Брауна: якщо на систему, що перебуває у стані хімічної рівноваги, подіяти ззовні (змінювати концентрацію, тиск, температуру), то в цій системі з більшою швидкістю відбуваються процеси, які послаблюють надану дію.
Контрольні запитання і вправи
1 Що називається хімічною рівновагою? Які фактори впливають на зміщення хімічної рівноваги?
2 В який бік зміститься хімічна рівновага в системах:
а) 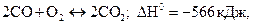
б) 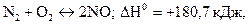
в) 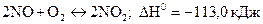 .
.
а) при підвищенні температури; б) при підвищенні тиску?
3 Константа рівноваги реакції
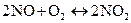
при 4940 С дорівнює 2,2. У стані рівноваги 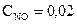 моль/л,
моль/л, 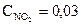 моль/л. Розрахуйте вихідну концентрацію кисню.
моль/л. Розрахуйте вихідну концентрацію кисню.
Практична частина
Мета роботи – вивчити вплив різних факторів на встановлення та зміщення хімічної рівноваги.
Обладнання і реактиви: шпатель,пробірки, амоній хлорид; розчини: калій дихромату (0,5 Н), сульфатної кислоти (0,5 Н), калій гідроксиду (0,5 Н), ферум(ІІІ) хлориду (0,0025 Н, насичений ), амоній роданіду (0,0025 Н, насичений ).
|
|
|
ДОСЛІД 3.3.1 Вплив концентрації реагуючих речовин на зміщення хімічної рівноваги
Реакція між ферум(ІІІ) хлоридом та амоній тіоціонатом відбувається за рівнянням
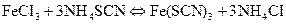 .
.
Різне забарвлення реагентів та продуктів реакції дає змогу спостерігати зміщення хімічної рівноваги залежно від концентрації речовин. Утворений у результаті реакції ферум(ІІІ) тіоціонат має криваво-червоне забарвлення. За зміною інтенсивності забарвлення розчину можна робити висновок щодо його концентрації. Якщо при зміні умов червоне забарвлення розчину посилюється, то рівновага зміщується вправо. При зменшенні інтенсивності забарвлення рівновага зміщується вліво.
У пробірку на 1/4 налити 0,0025 Н розчин ферум(ІІІ) хлориду і долити такий самий об’єм 0,0025 Н розчину амоній роданіду. Отриманий розчин розлити порівну у чотири пробірки. Одну пробірку зберігати для порівняння результатів досліду. В інші пробірки додати такі реактиви: у першу – 1 краплю насиченого розчину ферум(ІІІ) хлориду, у другу – 1 краплю насиченого розчину амоній роданіду, у третю декілька кристаликів амоній хлориду. Порівняти інтенсивність забарвлення отриманих розчинів з інтенсивністю забарвлення еталону. Результати досліду записати в таблицю за такою формою:
|
|
|
| Номер пробірки | Формула речовини, яку доѴавали | Висновок про зміну інтенсивності забарвлення | Напрямок зміщення рівноваги (вправо, вліво) |
| 1 | |||
| 2 | |||
| 3 | |||
| 4 |
Пояснити результати досліду, виходячи з принципу Ле Шательє - Брауна. Скласти вираз константи рівноваги даного процесу. Користуючись цим виразом, пояснити зміну забарвлення в кожній пробірці. Зробити висновок про вплив зміни концентрації речовин на хімічну рівновагу.
ДОСЛІД 3.3.2 Вплив середовища на зміщення хімічної рівноваги
Солі хромової кислоти – хромати – мають жовте забарвлення, а солі дихромової кислоти – дихромати – оранжеве. У розчинах цих солей встановлюється рівновага
|
| |
| хромат-іон | дихромат-іон |
| (жовтий) | (оранжевий), |
яка легко зміщується при зміні концентрації йонів Гідрогену.
У пробірку налити 1 мл розчину калій дихромату і долити такий самий об’єм розчину калій гідроксиду. Спостерігати перехід забарвлення. Потім до цього ж розчину додавати розчин сульфатної кислоти до того часу, поки забарвлення розчину не стане таким, яким було спочатку. Пояснити результати досліду, виходячи з принципу Ле Шательє - Брауна.
|
|
|
Дата добавления: 2019-02-13; просмотров: 145; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!