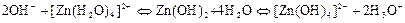Література для оформлення роботи і підготовки
теоретичного матеріалу
Опрацювати підрозділ 9.2 підручника [6] та підрозділ 3.2.2 посібника [3].
Лабораторна робота 6 Електролітична дисоціація
Теоретична частина
Процес розпаду електроліту на йони під дією полярних молекул розчинника (наприклад, води) називають електролітичною дисоціацією. Наслідком електролітичної дисоціації є електрична провідність розчинів електролітів (кислот, основ, солей).
Електролітична дисоціація – процес оборотний, і в розчинах встановлюється рівновага між йонами та молекулами. Відношення числа молекул, що розпалися на йони ( 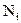 ), до загальної кількості розчинених молекул (
), до загальної кількості розчинених молекул ( 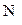 ) електроліту називається ступенем дисоціації
) електроліту називається ступенем дисоціації 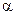 :
:
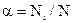 .
.
Ступінь дисоціації електроліту визначається експериментально і виражається в частках одиниці або у відсотках. Ступінь дисоціації залежить від природи електроліту, його концентрації, природи розчинника, наявності в розчині однойменних йонів.
За ступенем дисоціації електроліти поділяють на сильні, середні та слабкі. До сильних електролітів відносять ті, що в 0,1 М розчині мають 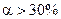 . Сильними електролітами є практично всі солі, багато мінеральних кислот (
. Сильними електролітами є практично всі солі, багато мінеральних кислот ( 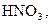
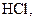
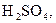
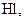
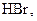
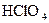 та ін.), основи лужних та лужноземельних металів. У електролітів середньої сили
та ін.), основи лужних та лужноземельних металів. У електролітів середньої сили 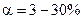 в 0,1 М розчинах; до таких відносять, наприклад,
в 0,1 М розчинах; до таких відносять, наприклад, 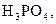
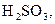
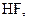
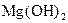 . У слабких електролітів
. У слабких електролітів 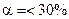 в 0,1 М розчинах; до таких відносять, наприклад,
в 0,1 М розчинах; до таких відносять, наприклад, 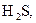
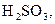
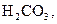

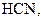
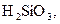
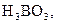
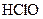 та ін., а також більшість багатокислотних основ та
та ін., а також більшість багатокислотних основ та  і
і 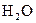 .
.
|
|
|
Багатоосновні кислоти та багатокислотні основи дисоціюють ступінчасто.
Крім ступеня дисоціації, стан слабких електролітів характеризує константа дисоціації 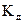 (константа рівноваги процесу дисоціації). Наприклад, для
(константа рівноваги процесу дисоціації). Наприклад, для 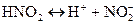 :
:
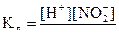 .
.
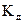 дає більш загальну характеристику електроліту, ніж ступінь дисоціації, вона залежить від температури, природи електроліту і природи розчинника.
дає більш загальну характеристику електроліту, ніж ступінь дисоціації, вона залежить від температури, природи електроліту і природи розчинника.
Між константою і ступенем дисоціації слабкого електроліту існує взаємозв`язок, який при невеликих розведеннях має вигляд 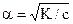 і є математичним виразом закону розведення Оствальда.
і є математичним виразом закону розведення Оствальда.
Зміщення йонної рівноваги, яке приводить до збільшення або зменшення ступеня дисоціації слабкого електроліту, здійснюється за принципом Ле Шательє- Брауна. Введення в розчин однойменного йона, тобто збільшення концентрації одного з продуктів реакції, приводить до зміщення йонної рівноваги в бік утворення молекул або до зменшення ступеня дисоціації електроліту. Навпаки, зв’язування одного з йонів у малодисоційовану сполуку приводить до підвищення ступеня дисоціації електроліту.
Контрольні запитання і вправи
1 Як зміниться концентрація катіонів Гідрогену в розчинах кислот при введенні в них однойменних аніонів: а)  ; б)
; б) 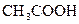 ; в)
; в) 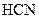 ; г)
; г) 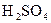 ?
?
|
|
|
2 Складіть рівняння ступінчастої дисоціації для слабких електролітів: 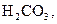
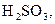
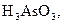
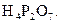
3 Розчини яких речовин необхідно взяти, щоб отримати осад аргентум ортофосфату? Складіть молекулярне та йонне рівняння цього процесу.
4 При якій концентрації 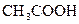 у водному розчині
у водному розчині 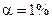 , якщо
, якщо 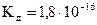 ?
?
Практична частина
Мета роботи –дослідити характер електролітичної дисоціації розчинів електролітів і її залежність від різних факторів.
Обладнання і реактиви: мікрошпатель, пробірки, натрій ацетат, амоній хлорид; індикатори: метиловий оранжевий, фенолфталеїн, розчини: калій гідроксиду (0,5 Н), хлоридної кислоти (2 Н, 0,5 Н, 0,1 Н), оцтової кислоти (2 Н, 0,1 Н), магній хлориду (0,5 Н), алюміній хлориду (0,5 Н), натрій силікату (0,5 Н), нікель(ІІ) сульфату (0,5 Н), цинк сульфату (0,5 Н), амоній гідроксиду (0,1Н).
ДОСЛІД 3.6.1 Характер дисоціації гідроксидів
Пронумерувати 5 пробірок і внести по 1мл таких розчинів: у першу пробірку 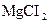 , у другу –
, у другу – 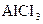 , у третю –
, у третю – 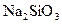 , у четверту –
, у четверту – 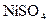 , у п’яту –
, у п’яту – 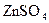 . У пробірки під номерами 1, 2, 4, 5 додавати по краплях розчин калій гідроксиду до появи осадів, у пробірку під номером 3 – розчин хлоридної кислоти. Отримані осади поділити на дві частини. До першої частини осадів долити надлишок розчину калій гідроксиду, а до другої частини осадів долити розчин хлоридної кислоти. В яких випадках відбувається розчинення того чи іншого осаду? Скласти рівняння проведених хімічних реакцій. Зробити висновок про кислотно-основні властивості гідроксидів: назвати серед них основи, амфотерні гідроксиди та кислоти. Заповнити таблицю за такою формою:
. У пробірки під номерами 1, 2, 4, 5 додавати по краплях розчин калій гідроксиду до появи осадів, у пробірку під номером 3 – розчин хлоридної кислоти. Отримані осади поділити на дві частини. До першої частини осадів долити надлишок розчину калій гідроксиду, а до другої частини осадів долити розчин хлоридної кислоти. В яких випадках відбувається розчинення того чи іншого осаду? Скласти рівняння проведених хімічних реакцій. Зробити висновок про кислотно-основні властивості гідроксидів: назвати серед них основи, амфотерні гідроксиди та кислоти. Заповнити таблицю за такою формою:
|
|
|
| Назва гідроксиду | Формула гідроксиду | Хімічні властивості | Схема дисоціації (без ступенів) |
| Магній гідроксид | |||
| Алюміній гідроксид | |||
| Силіцій гідроксид |
Яка кількість електронів на зовнішньому енергетичному рівні йонів  та атома
та атома 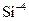 ? Як впливає зростання заряду йонів (ступеня окиснення атомів) на характер хімічних властивостей гідроксидів?
? Як впливає зростання заряду йонів (ступеня окиснення атомів) на характер хімічних властивостей гідроксидів?
Радіуси йонів  та атома
та атома 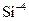 відповідно дорівнюють (за Полінгом) 0,065; 0,50 та 0,041 нм. Як впливає зростання радіуса йона на характер хімічних властивостей гідроксидів?
відповідно дорівнюють (за Полінгом) 0,065; 0,50 та 0,041 нм. Як впливає зростання радіуса йона на характер хімічних властивостей гідроксидів?
Скласти таблицю за такою формою:
| Йон, гідроксид якого розглядається | Радіус йона, нм | Зовнішня електронна оболонка | Хімічні властивості гідроксидів | Схема дисоціації (без ступенів) |
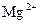
| 0,065 | |||

| 0,069 | |||

| 0,071 |
|
|
|
Як впливає зовнішня оболонка йонів на характер дисоціації гідроксидів, якщо відомо, що 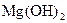 більш сильна основа, ніж
більш сильна основа, ніж 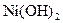 ?
?
Зробити загальний висновок щодо впливу радіуса, заряду та зовнішньої оболонки на характер дисоціації гідроксидів.
При складанні схем дисоціації амфотерних гідроксидів урахувати, що в лужних розчинах вони переходять в комплексні гідроксойони. Наприклад, схему дисоціації амфотерного цинк гідроксиду записують так:
|
| |
| у кислому середовищі | у лужному середовищі |
ДОСЛІД 3.6.2 Порівняння хімічної активності кислот
У першу пробірку налити 1 мл розчину хлоридної кислоти (2 Н), у другу пробірку -1 мл розчину оцтової кислоти (2 Н), вибрати два приблизно однакових за розміром шматочки крейди і кинути по одному в кожну пробірку. Який газ виділяється? В якій пробірці процес відбувається більш енергійно? Скласти молекулярні та йонні рівняння хімічних реакцій. Від концентрації яких йонів залежить швидкість виділення газу? У розчині якої кислоти концентрація катіонів Гідрогену більша? Зробити висновок про силу досліджуваних кислот.
ДОСЛІД 3.6.3 Зміщення рівноваги дисоціації слабких електролітів
А У пробірку налити 2 мл розчину оцтової кислоти (0,1 Н) і додати 1 краплю метилового оранжевого. Під впливом яких йонів метиловий оранжевий набув рожевого забарвлення? Вміст пробірки розлити порівну у дві пробірки. Одну пробірку з оцтовою кислотою залишити як контрольну, а в іншу внести 2-3 мікрошпателі натрій ацетату і ретельно збовтати пробірку. Порівняти забарвлення отриманого розчину із забарвленням розчину у контрольній пробірці. На зміну концентрації яких йонів вказує зміна забарвлення метилового оранжевого? Скласти рівняння дисоціації оцтової кислоти і вираз константи її дисоціації. Пояснити, як зміщується рівновага дисоціації кислоти при додаванні до неї натрій ацетату. Як змінюється при цьому ступінь дисоціації оцтової кислоти і концентрація катіонів 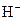 ?
?
Б У пробірку налити 2 мл розчину амоній гідроксиду (0,1 Н) і додати 1 краплю фенолфталеїну. Під впливом яких йонів фенолфталеїн набув малинового забарвлення? Вміст пробірки розлити порівну у дві пробірки. Одну пробірку з амоній гідроксидом залишити як контрольну, а в іншу внести 2-3 мікрошпателі амоній хлориду і ретельно збовтати пробірку. Порівняти забарвлення отриманого розчину із забарвленням розчину у контрольній пробірці. Про зміну концентрації яких йонів свідчить зміна забарвлення фенолфталеїну? Скласти рівняння дисоціації амоній гідроксиду і вираз константи його дисоціації. Пояснити, як зміщується рівновага дисоціації амоній гідроксиду при додаванні до нього амоній хлориду. Як змінюється при цьому ступінь дисоціації амоній гідроксиду і концентрація катіонів 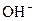 ?
?
Дата добавления: 2019-02-13; просмотров: 116; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!