Література для оформлення роботи і підготовки
теоретичного матеріалу
Опрацювати підрозділи 11.1, 11.8 підручника [6] та підрозділи 4.1, 4.2 посібника [3].
Лабораторна робота 10 Гальванічні елементи
Теоретична частина
Окисно-відновний потенціал металу називають електродним потенціалом 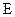 , оскільки метал виконує функцію електрода. Найчастіше його вимірюють відносно стандартного водневого електрода, потенціал якого умовно беруть за такий, що дорівнює нулю (
, оскільки метал виконує функцію електрода. Найчастіше його вимірюють відносно стандартного водневого електрода, потенціал якого умовно беруть за такий, що дорівнює нулю ( 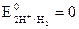 ). Різницю потенціалів у ланцюгу
). Різницю потенціалів у ланцюгу
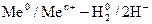
при активності металу, що дорівнює 1 моль/л, і при температурі 250 С називають стандартним електродним потенціалом металу ( 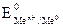 ).
).
Якщо на металічному електроді відбувається процес окиснення, його електродний потенціал має негативне значення ( 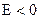 ). Якщо на металічному електроді відбувається процес окиснення, його електродний потенціал має позитивне значення (
). Якщо на металічному електроді відбувається процес окиснення, його електродний потенціал має позитивне значення ( 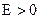 ).
).
Розташовуючи метали у порядку зростання стандартних електродних потенціалів, отримують електрохімічний ряд напруг металів :
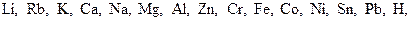 Чим менше значення
Чим менше значення 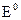 , тим сильніше виражена відновна здатність металів і тим слабкіше виражені окисні властивості їх йонів.
, тим сильніше виражена відновна здатність металів і тим слабкіше виражені окисні властивості їх йонів.
Електродний потенціал металу можна розрахувати за рівнянням Нернста:
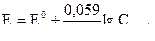 (при 250 С),
(при 250 С),
де 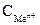 - молярна концентрація йонів металу у розчині;
- молярна концентрація йонів металу у розчині; 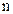 - заряд йона металу.
- заряд йона металу.
Гальванічний елемент – це джерело електричної енергії, яка утворюється за рахунок окисно – відновного процесу. Реакція окиснення відбувається на одному електроді (аноді), а реакція відновлення – на іншому (катоді). Роль катода виконує метал з меншим значенням електродного потенціалу (  ).
).
|
|
|
У кадмієво-цинковому гальванічному елементі
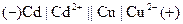 ,
,
де 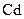 – анод, негативно заряджений електрод, джерело електронів;
– анод, негативно заряджений електрод, джерело електронів;  – катод, позитивно заряджений електрод.
– катод, позитивно заряджений електрод.
В елементі відбувається реакція:
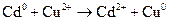 ,
,
(анод) 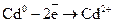 (окиснення),
(окиснення),
(катод) 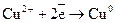 (відновлення).
(відновлення).
ЕРС (  ) гальванічного елемента дорівнює різниці електродних потенціалів катода та анода:
) гальванічного елемента дорівнює різниці електродних потенціалів катода та анода:
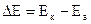 .
.
Стандартна ЕРС гальванічного елемента дорівнює 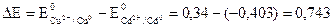 В.
В.
Гальванічний елемент може бути складений не лише з електродів, що представлені різними металами, але й з електродів одного металу, занурених у розчини одного й того ж електроліту, проте з різною концентрацією йонів. Такий гальванічний елемент називається концентраційним.
Контрольні запитання і вправи
1 Розрахуйте електродний потенціал срібла, поміщеного в розчин його солі з концентрацією 0,001 моль/л ( 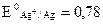 В).
В).
2 Складіть схеми двох елементів, в одному з яких свинець є анодом, а в іншому – катодом. Складіть рівняння електродних процесів і розрахуйте стандартні ЕРС цих елементів.
3 Розрахуйте ЕРС концентраційного гальванічного елемента, складеного з двох мідних електродів, один з яких поміщений в розчин 0,001 М купрум(ІІ) сульфату, а інший – в 1 М розчин купрум(ІІ) сульфату.
|
|
|
Практична частина
Мета роботи –визначити ЕРС гальванічних елементів.
Обладнання і реактиви: мілівольтметр, U-подібний електролітичний місток, хімічні стакани, пробірки, пластинки міді, заліза, свинцю, цинку, сіль Мора; розчини: калій хлориду (насич.), купрум(ІІ) сульфату (1 М), цинк сульфату (1 М, 0,01 М), плюмбум(ІІ) нітрату (0,5 Н), аргентум нітрату (0,1 М).
ДОСЛІД 3.10.1 Порівняльна активність металів
Налити у 5 пробірок по 1 млрозчинів солей: у першу – цинк сульфату, у другу – розчину солі Мора, у третю плюмбум(ІІ) нітрату, у четверту – купрум(ІІ) сульфату, у п’яту – аргентум нітрату. Помістити в розчини пластинки металічного цинку. Відмітити спостереження. Повторити досліди із залізними, свинцевими та мідними пластинками. З розчинів яких солей витісняються метали? Записати метали в порядку зменшення їх відновної активності. Порівняти експериментальний ряд металів з їх положенням в електрохімічному ряді напруг.
ДОСЛІД 3.10.2 Вимірювання ЕРС гальванічного елемента
|
|
|
Скласти гальванічний елемент за схемою
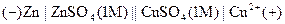 .
.
Для цього в стакани з розчинами солей металів занурити пластинки відповідних металів, замкнути півелементи соляним містком і сполучити електроди за з мікровольтметром. Виміряти ЕРС після встановлення стаціонарного значення напруги на шкалі приладу.
Записати схему гальванічного елемента, показати напрямок руху електронів у зовнішньому ланцюгу, скласти рівняння електродних процесів і сумарне рівняння реакції, в результаті якої утворюється електричний струм, розрахувати теоретичне значення ЕРС. Порівняти отримане значення ЕРС з розрахованим теоретично. Визначити відносну похибку вимірювання.
ДОСЛІД 3.10.3 Концентраційний гальванічний елемент
Занурити пластинки відповідних металів у стакани з розчинами солей цинку різної концентрації: перший стаканчик – 1 М 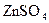 , другий – 0,01 М
, другий – 0,01 М 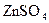 . Замкнути півелементи соляним містком і сполучити електроди з мікровольтметром. Виміряти ЕРС після встановлення стаціонарного значення напруги на шкалі приладу.
. Замкнути півелементи соляним містком і сполучити електроди з мікровольтметром. Виміряти ЕРС після встановлення стаціонарного значення напруги на шкалі приладу.
Записати схему гальванічного елемента, показати напрямок руху електронів у зовнішньому ланцюгу , скласти рівняння електродних процесів, розрахувати теоретичне значення ЕРС. Порівняти отримане значення ЕРС з розрахованим теоретично. Визначити відносну похибку вимірювання.
|
|
|
Дата добавления: 2019-02-13; просмотров: 143; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
