Список літератури для оформлення роботи і підготовки
теоретичного матеріалу
Опрацювати розділ «Головна підгрупа другої групи» посібника [1] і 5.5 посібника [3].
Лабораторна робота 13 Дослідження властивостей алюмінію та сполук Алюмінію
Теоретична частина
Дометалів ІІІА-групи, крім Алюмінію 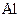 , належать також елементи підгрупи Галію – Галій Ga, Індій In, Талій TI, їх атоми мають ns2np1- конфігурацію валентного рівня. У сполуках усі елементи головної ІІІА-групи виявляють ступінь окиснення +3. Проте вони можуть виявляти нижчий ступінь окиснення +1; ця здатність посилюється від Бору до Талію. Для Талію найстійкішими є сполуки зі ступенем окиснення +1.
, належать також елементи підгрупи Галію – Галій Ga, Індій In, Талій TI, їх атоми мають ns2np1- конфігурацію валентного рівня. У сполуках усі елементи головної ІІІА-групи виявляють ступінь окиснення +3. Проте вони можуть виявляти нижчий ступінь окиснення +1; ця здатність посилюється від Бору до Талію. Для Талію найстійкішими є сполуки зі ступенем окиснення +1.
Найбільше практичне значення з усіх елементів ІІІ А-групи має Алюміній. Алюміній – це сріблястий метал із температурою плавлення 6600 С, густиною 2,7 г/см3. Алюміній м’який і пластичний метал, добре кується, витягується у дріт. На повітрі він вкривається дуже тонкою (~10-5 мм) плівкою Al2O3, яка характеризується високою міцністю і щільністю.
Про високу відновну активність алюмінію свідчать значення його стандартних електродних потенціалів у кислому та лужному середовищах:

Алюміній легко взаємодіє з водою після видалення з його поверхні оксидної плівки, витісняє водень з хлоридної і розбавленої сульфатної кислот, за кімнатної температури завдяки пасивації виявляє стійкість до дуже концентрованих розчинів нітратної і сульфатної кислот, легко розчиняється у розчинах лугів з утворенням аніонного комплексу 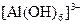 .
.
|
|
|
Алюміній широко використовується в електротехніці завдяки високій електро- і теплопровідності. Оскільки він є легким металом, тому широко застосовується у конструкціях, власна маса яких має вирішальне значення(ракети, літаки), для виготовлення побутових речей, тари. Застосовують як чистий алюміній, так і його сплави: дюралюмін, електрон, силумін, магналій. Дюралюмін – основний матеріал у літакобудуванні. Велика кількість алюмінію витрачається на виготовлення проводів. Порошкоподібний алюміній використовують як сріблясту фарбу.
Оксид і гідроксид Алюмінію є амфотерними сполуками з перевагою основних властивостей.
Солі алюмінію, утворені сильними кислотами, підлягають гідролізу у водних розчинах і мають кислу реакцію середовища. Солі слабких кислот (АI2S3, AI2(CO3)3 та ін.) гідролізуються необоротно.
У комплексних сполуках, утворених йоном АІ3+, його координаційне число дорівнює 4 і 6 (наприклад Na[AI(OH)4] і Na3 [AI(OH)6]).
Контрольні запитання і вправи
1 Скласти рівняння хімічних реакцій за наведеними схемами. В результаті яких реакцій виділяється водень:
a) Al + NaOH →;
|
|
|
б) Al + H2O →;
в) Al + HNO3(розб)→;
г) Al + H2SO4(розб)→?
2 Якщо на розчини алюміній сульфату однакової концентрації подіяти невеликими кількостями розчинів калій гідроксиду і амоній гідроксиду, то випадають білі осади. При подальшому додаванні надлишків KOH і NH4OH один із осадів розчиняється. Зазначити, в якому саме. Скласти рівняння хімічних реакцій.
3 Які перетворення можна здійснити, використовуючи натрій гідроксид:
a) алюміній оксид → натрій метаалюмінат;
б) алюміній → водень;
в) алюміній → алюміній нітрат;
г) алюміній → алюміній гідроксид.
Скласти рівняння хімічних реакцій.
4 Яку однакову речовину можна використати для перетворень за такими схемами:
a) алюміній → водень;
б) алюміній карбід→ метан?
Скласти рівняння хімічних реакцій.
5 Яка речовина випадає в осад у результаті таких реакцій:
a) алюміній сульфід + вода→;
б) алюміній карбонат + вода→?
Скласти рівняння хімічних реакцій.
Практична частина
Мета роботи –дослідити хімічні властивості алюмінію та сполук Алюмінію.
Обладнання і реактиви: штатив для пробірок, пробірки, пробіркотримач, нагрівний прилад, сухе пальне, порцелянова ступка з товкачиком, лійка, фільтр, піпетка, алюміній (порошок, фольга або дріт), йод кристалічний, дистильована вода, розчини: фенолфталеїну, фуксину, натрій гідроксиду (2 Н), хлоридної кислоти (2 Н, ρ=1,19 г/см3), сульфатної кислоти (2 Н, ρ=1,84 г/см3), нітратної кислоти (ρ=1,4 г/см3), алюміній хлориду (0,5 Н), алюміній сульфату (0,5 Н), купрум(ІІ) сульфату (0,5 Н), купрум(ІІ) хлориду (0,5 Н).
|
|
|
ДОСЛІД 3.13.1 Взаємодія алюмінію з кислотами
А На підставі положення алюмінію в електрохімічному ряді напруг металів зробити висновок про можливість його взаємодії з розбавленими розчинами хлоридної і сульфатної кислот.
Перевірити правильність висновку на досліді, для цього у дві пробірки помістити невеличку кількість алюмінієвого порошку і добавити в одну пробірку 2 Н розчин хлоридної кислоти, а в другу – 2 Н розчин сульфатної кислоти. Порівняти активність взаємодії алюмінію з цими кислотами за кімнатної температури і при нагріванні. Скласти рівняння хімічних реакцій.
Увага! Досліди з концентрованими розчинами кислот необхідно виконувати у витяжній шафі!
Б У дві пробірки помістити по невеличкому шматочку алюмінієвої фольги. В одну пробірку налити 0,5 мл концентрованої нітратної кислоти, в другу – 0,5 мл концентрованої сульфатної кислоти. Чи відбувається розчинення алюмінію в концентрованих розчинах кислот?
|
|
|
Обережно нагріти пробірки. Що спостерігається? Скласти рівняння реакцій взаємодії алюмінію з концентрованими нітратною та сульфатною кислотами при нагріванні. Зробити висновок про особливості взаємодії алюмінію з кислотами.
ДОСЛІД 3.13.2 Взаємодія алюмінію з лугом
У пробірку помістити декілька шматочків алюмінієвої фольги і долити розчин натрій гідроксиду. Що спостерігається? Скласти рівняння хімічної реакції.
ДОСЛІД 3.13.3 Взаємодія алюмінію з розчинами солей
У дві пробірки помістити по шматочку алюмінієвої фольги. В першу пробірку налити 1 мл розчину купрум(ІІ) сульфату, а в другу – 1 мл розчину купрум(ІІ) хлориду і залишити в штативі на 5 хвилин. Через зазначений проміжок часу відзначити, як змінилася поверхня алюмінію. Описати спостереження, пояснити їх. Скласти рівняння реакцій.
ДОСЛІД 3.13.4 Взаємодія алюмінію з неметалами
Увага! Дослід необхідно виконувати у витяжній шафі!
У порцелянову ступку помістити по одному мікрошпателю порошку йоду і порошку алюмінію. Ретельно перемішати і розтерти суміш. Добавити до суміші 1-2 краплі дистильованої води. Накрити суміш скляним стаканом. Що спостерігається? Навіщо до реакційної суміші добавляють воду? Пояснити результати спостережень, скласти рівняння хімічної реакції.
ДОСЛІД 3.13.5 Добування і властивості алюміній гідроксиду
А До розчину солі алюмінію у пробірці приливати по краплях розчин натрій гідроксиду до утворення осаду. Що являє собою осад, який він має колір? Скласти рівняння хімічної реакції в молекулярному та йонному вигляді.
Б Розділити утворений осад на дві пробірки. В одну пробірку налити розбавлену хлоридну кислоту, а в іншу – розчин лугу. Що спостерігається? Зробити висновок про хімічний характер алюміній гідроксиду. Скласти рівняння хімічних реакцій в молекулярному та йонному вигляді, враховуючи, що утворюється комплексний йон [AI(OH)6]3-. Як зміщується рівновага дисоціації алюміній гідроксиду при додаванні надлишку лугу, надлишку кислоти?
В Отримати осад алюміній гідроксиду, відфільтрувати його та промити осад на фільтрі дистильованою водою. Пропустити крізь фільтр з осадом розбавлений розчин органічного барвника – фуксину. Як змінюється забарвлення фільтрату? Про які властивості алюміній гідроксиду свідчить цей дослід?
Дата добавления: 2019-02-13; просмотров: 155; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
